题目内容
下列说法不正确的是( )
| A.漂白粉长时间露置空气中会变质失效 |
| B.澄清石灰水可用来鉴别Na2CO3和NaHCO3溶液 |
| C.高温下SiO2能与Na2CO3反应放出CO2,但不能说明H2SiO3的酸性强于H2CO3 |
| D.金属的化学腐蚀和电化学腐蚀的本质相同,但电化学腐蚀伴有电流产生 |
B
试题分析:A选项,正确,漂白粉久置空气会失效(涉及两个反应):Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,2HClO
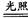 2HCl+O2↑,漂白粉变质会有CaCO3存在,外观上会结块。;B选项,不正确,与Ca(OH)2溶液反应:Na2CO3、NaHCO3溶液中均有白色沉淀生成;C选项,正确,较强的酸能把较弱的酸从其盐溶液中制取出来,这是复分解反应的一般规律,因为C比Si非金属性强,碳酸比硅酸酸性强;由此对于反应Na2SiO3+CO2+H2O=Na2CO3+H4SiO4↓的发生是不难理解的,而反应Na2CO3+SiO2
2HCl+O2↑,漂白粉变质会有CaCO3存在,外观上会结块。;B选项,不正确,与Ca(OH)2溶液反应:Na2CO3、NaHCO3溶液中均有白色沉淀生成;C选项,正确,较强的酸能把较弱的酸从其盐溶液中制取出来,这是复分解反应的一般规律,因为C比Si非金属性强,碳酸比硅酸酸性强;由此对于反应Na2SiO3+CO2+H2O=Na2CO3+H4SiO4↓的发生是不难理解的,而反应Na2CO3+SiO2 Na2SiO3+CO2↑居然也能进行,这是因为在高温反应条件下高沸点制低沸点(也可看成熵增,动力学因素);D选项,正确,金属腐蚀的本质主要是金属原子失电子被氧化,腐蚀主要有化学腐蚀和电化学腐蚀,两者的区别是当电化学腐蚀发生时,金属表面存在隔离的阴极与阳极,有微小的电流存在于两极之间,单纯的化学腐蚀则不形成微电池。
Na2SiO3+CO2↑居然也能进行,这是因为在高温反应条件下高沸点制低沸点(也可看成熵增,动力学因素);D选项,正确,金属腐蚀的本质主要是金属原子失电子被氧化,腐蚀主要有化学腐蚀和电化学腐蚀,两者的区别是当电化学腐蚀发生时,金属表面存在隔离的阴极与阳极,有微小的电流存在于两极之间,单纯的化学腐蚀则不形成微电池。
练习册系列答案
相关题目