题目内容
某反应池中,发生“生物硝化过程”,利用O2将NH4+氧化成NO3-,如果不考虑过程中硝化细菌的增殖,其净反应如下式所示:

1、完成上述反应的离子方程式并配平,将系数填入方框中,并标出电子的转移方向和数目。
2、反应中,还原剂是 ,被还原的元素是 。
3、将铵态氮中的lmg氮转化成硝酸根中的氮,需氧气 mg。(精确到0.01)
4、取100mL完全反应以后的溶液,加入19.2g铜粉及一定量的稀硫酸,恰好完全反应(假设还原产物全部是NO气体),则原溶液中NH4+的浓度为 mol/L。(假设反应前后溶液的体积不变)

1、完成上述反应的离子方程式并配平,将系数填入方框中,并标出电子的转移方向和数目。
2、反应中,还原剂是 ,被还原的元素是 。
3、将铵态氮中的lmg氮转化成硝酸根中的氮,需氧气 mg。(精确到0.01)
4、取100mL完全反应以后的溶液,加入19.2g铜粉及一定量的稀硫酸,恰好完全反应(假设还原产物全部是NO气体),则原溶液中NH4+的浓度为 mol/L。(假设反应前后溶液的体积不变)
1、
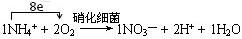
2、NH4+ (1分)、O2中的O (1分)
3、4.57 (1分)
4、2 (2分)
(1)由原子守恒和电荷守恒及电子得失守恒,可得配平方程式:
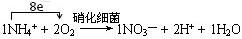
(2)根据化合价的升降可知,还原剂为NH4+,氧元素被还原;
(3)由方程式可知,14gN被64g氧气氧化,则将铵态氮中的lmg氮转化成硝酸根中的氮,需氧气 4.57mg
(4)3Cu + 2NO3— + 8H+ = 3Cu2+ + 2NO + 4H2O,结合本题可得:
NH4+ ~ NO3—~3Cu
可计算出19.2g铜粉对应的NH4+为0.2 mol,则其物质的量浓度为2 mol/L
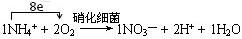
(2)根据化合价的升降可知,还原剂为NH4+,氧元素被还原;
(3)由方程式可知,14gN被64g氧气氧化,则将铵态氮中的lmg氮转化成硝酸根中的氮,需氧气 4.57mg
(4)3Cu + 2NO3— + 8H+ = 3Cu2+ + 2NO + 4H2O,结合本题可得:
NH4+ ~ NO3—~3Cu
可计算出19.2g铜粉对应的NH4+为0.2 mol,则其物质的量浓度为2 mol/L

练习册系列答案
相关题目