题目内容
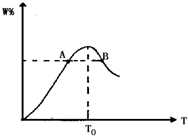 将物质的量均为2.00mol的物质X、Y混合,发生如下反应:2X+Y
将物质的量均为2.00mol的物质X、Y混合,发生如下反应:2X+Y 2W.在反应过程中W的物质的量分数随温度变化如图所示:
2W.在反应过程中W的物质的量分数随温度变化如图所示:(1)T0对应的V正和V逆的关系是V正
等于
等于
V逆 (填“>”、“<”或“=”);(2)此反应的正反应为
放
放
热反应;(3)A、B两点正反应速率的大小关系是A
小于
小于
B.(填“>”、“<”或“=”).分析:起始时加入物质的量均为2.00mol的物质X、Y,随着温度的升高,反应向正反应方向进行,当温度达到T0时,W的物质的量分数最大,说明达到反应的最大限度,即平衡状态,此时正逆反应速率相等,随着温度的继续升高,W的物质的量分数逐渐减小,说明温度升高平衡左移,温度越高,反应速率越大.
解答:解:(1)起始时加入物质的量均为2.00mol的物质X、Y,随着温度的升高,反应向正反应方向进行,当温度达到T0时,W的物质的量分数最大,说明达到反应的最大限度,即平衡状态,此时正逆反应速率相等,故答案为:等于;
(2)随着温度的继续升高,W的物质的量分数逐渐减小,说明温度升高平衡左移,则正反应为放热反应,故答案为:放;
(3)温度越高,反应速率越大,B点温度大于A点,则A点反应速率小于B点,故答案为:小于.
(2)随着温度的继续升高,W的物质的量分数逐渐减小,说明温度升高平衡左移,则正反应为放热反应,故答案为:放;
(3)温度越高,反应速率越大,B点温度大于A点,则A点反应速率小于B点,故答案为:小于.
点评:本题考查反应速率的影响因素,题目难度不大,注意把握曲线的变化特点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
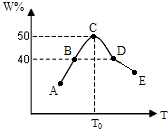 将5份物质的量均为2.0mol的X、Y混合,分别加入温度不同、容积相同(均为2L)的恒容容器中发生反应2X(g)+Y(g)?3W(g).经过相同时间10s时,五个容器中W的体积百分含量(W%)随温度(T)变化的关系如图.
将5份物质的量均为2.0mol的X、Y混合,分别加入温度不同、容积相同(均为2L)的恒容容器中发生反应2X(g)+Y(g)?3W(g).经过相同时间10s时,五个容器中W的体积百分含量(W%)随温度(T)变化的关系如图.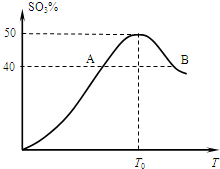 2L容器中,分别将物质的量均为2.00mol的SO2、O2混合,在不同温度(T)下发生如下反应:2SO2(g)+O2(g)?2SO3(g).并在第10s时分别测定其中SO3的物质的量分数(SO3%)并绘成如图所示曲线:
2L容器中,分别将物质的量均为2.00mol的SO2、O2混合,在不同温度(T)下发生如下反应:2SO2(g)+O2(g)?2SO3(g).并在第10s时分别测定其中SO3的物质的量分数(SO3%)并绘成如图所示曲线: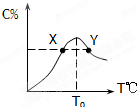 将物质的量均为3.00mol物质A、B混合于5L溶 器中,发生如下反应 3A+B?2C,在反应过程中C的物质的量分数随温度变化如图所示:
将物质的量均为3.00mol物质A、B混合于5L溶 器中,发生如下反应 3A+B?2C,在反应过程中C的物质的量分数随温度变化如图所示: 2Z(g);△H<0若达到平衡时气体总物质的量变为原来的0.85倍。请回答下列问题。
2Z(g);△H<0若达到平衡时气体总物质的量变为原来的0.85倍。请回答下列问题。

