题目内容
1.下列叙述正确的是( )| A. | 在晶体硅中,Si原子与Si-Si键数目比为1:2 | |
| B. | 分子晶体中都存在范德华力,分子内都存在共价键 | |
| C. | HF、HCl、HBr、HI四种物质的沸点依次升高 | |
| D. | 干冰和氯化铵分别受热变为气体所克服的粒子间相互作用属于同种类型 |
分析 A.在硅晶体中,每个硅原子形成2个Si-Si键;
B.稀有气体为单原子分子不含化学键;
C.HF中存在氢键,氢键的存在能使物质的沸点显著提高;
D.干冰属于分子晶体,氯化铵属于离子晶体
解答 解:A.在硅晶体中,每个硅原子形成2个Si-Si键,所以Si原子与Si-Si键数目比为1:2,故A正确;
B.稀有气体为单原子分子不含化学键,故B错误;
C.HF分子间含有氢键,沸点最高,HCl、HBr、HI,都不含氢键,都为分子晶体,分子间作用力越强,则熔沸点越高,HCl、HBr、HI沸点依次升高,故C错误;
D.干冰属于分子晶体,氯化铵属于离子晶体,受热变为气体所克服的粒子间相互作用分别为分子间作用力和离子键,故D错误,
故选:A.
点评 本题考查了离子晶体、原子晶体、分子晶体的结构和性质,氢键对物质物理性质的影响,题目难度不大,把握形成各种晶体的微粒和相互作用是解题的关键,注意稀有气体属于分子晶体但是不含化学键,氢键属于分子间作用力的一种,对物质的熔沸点、溶解性有显著的影响.

练习册系列答案
相关题目
11.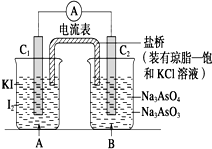 已知反应AsO${\;}_{4}^{3-}$+2I-+2H+?AsO${\;}_{3}^{3-}$+I2+H2O是可逆反应.设计如图装置
已知反应AsO${\;}_{4}^{3-}$+2I-+2H+?AsO${\;}_{3}^{3-}$+I2+H2O是可逆反应.设计如图装置
(C1、C2均为石墨电极),分别进行下述操作:
Ⅰ.向B烧杯中逐滴加入浓盐酸
Ⅱ.向B烧杯中逐滴加入40%NaOH溶液
结果发现电流表指针均发生偏转.据此,下列判断正确的是( )
 已知反应AsO${\;}_{4}^{3-}$+2I-+2H+?AsO${\;}_{3}^{3-}$+I2+H2O是可逆反应.设计如图装置
已知反应AsO${\;}_{4}^{3-}$+2I-+2H+?AsO${\;}_{3}^{3-}$+I2+H2O是可逆反应.设计如图装置(C1、C2均为石墨电极),分别进行下述操作:
Ⅰ.向B烧杯中逐滴加入浓盐酸
Ⅱ.向B烧杯中逐滴加入40%NaOH溶液
结果发现电流表指针均发生偏转.据此,下列判断正确的是( )
| A. | 操作Ⅰ过程中,C1为正极 | |
| B. | 操作Ⅱ过程中,盐桥中的K+移向B烧杯溶液 | |
| C. | Ⅰ操作过程中,C2棒上发生的反应为AsO${\;}_{4}^{3-}$+2H++2e-=AsO${\;}_{3}^{3-}$+H2O | |
| D. | Ⅱ操作过程中,C1棒上发生的反应为2I--2e-=I2 |
12.下列纯净物中既能跟氢气反应,又能跟高锰酸钾溶液反应,但既不能跟溴水发生加成反应,又不能发生加聚反应的是( )
| A. | 裂化汽油 | B. | 直馏汽油 | C. | 甲苯 | D. | 苯 |
9.据图判断下列说法正确的是( )


| A. | 图1中醋酸电离平衡常数:a点的比b点的小 | |
| B. | 图1中醋酸溶液的pH:a点的比b点的小 | |
| C. | 图2中c点对应的溶液为Fe(OH)3的不饱和溶液 | |
| D. | 由图2可知,欲除去CuSO4溶液中的Fe3+,可向溶液中加入CuO,调节pH约为4左右 |
6.下列化学措施不可行的是( )
| A. | 以 CH≡CH 和 HCl 反应制氯乙烯,进而制备聚氯乙烯塑料 | |
| B. | 浓氨水滴入生石灰中,将产生的气体通入 AlCl3溶液,可得到含AlO2-的溶液 | |
| C. | 使用催化剂不能改变工业合成 NH3 的反应限度 | |
| D. | 用浸有 KMnO4溶液的硅土来吸收水果释放的乙烯 |
13.下列说法中错误的是( )
| A. | 卤化氢中,以HF沸点最高,是由于HF分子间存在氢键 | |
| B. | 邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点低 | |
| C. | N2分子中有一个σ键,2个π键 | |
| D. | 在元素周期表中,s区,d区和ds区的元素都是金属 |
10.一定温度下,某密闭容器中发生如下反应:A(g)+B(g)?C(g)+D(g)△H<0.当反应达到平衡时测得容器中各种物质均为amol.欲使C的平衡浓度增大一倍,在其他条件不变时,下列措施可采用的是( )
| A. | 降低温度 | B. | 恒容时,再通入2amolC和2amolD | ||
| C. | 恒压时,再通入2amolC和2amolD | D. | 恒容时,再通入amolA和amolB |