题目内容
填空并写出下列反应的热化学方程式:
(1)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂过氧化氢,当它们混合时,即产生大量氧气和水蒸气,并放出大量热。已知0.4mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出256.65kJ的热量。
①写出肼和过氧化氢的电子式: 肼___________,过氧化氢___________ 。
②写出热化学方程式________________________。
③已知H2O(1)=H2O(g) △H=+44kJ/mol,则64g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是_________ kJ。
(2)NA表示阿伏加德罗常数,在CH4(g)完全燃烧生成CO2和液态水的反应中,每有
4NA个电子转移时,放出445kJ的热量。 _______________________________
(3)已知拆开1molN≡N键,1molH-H键,1molN-H键分别需要的能量是a kJ、b kJ、c kJ,则N2与H2反应生成NH3的热化学方程式为: ______________________________
(4)已知:
N2(g)+2O2(g)===2NO2(g) ΔH=+67.7 kJ/mol①
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-543 kJ/mol②
1/2H2(g)+1/2F2(g)===HF(g) ΔH=-269 kJ/mol③
H2(g)+1/2O2(g)===H2O(g) ΔH=-242 kJ/mol④
①写出肼(N2H4)和NO2反应的热化学方程式_____________________________________。
②有人认为若用氟气代替二氧化氮作氧化剂,则反应释放的能量更大,肼和氟气反应的热化学方程式为_________________________________。
(1)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂过氧化氢,当它们混合时,即产生大量氧气和水蒸气,并放出大量热。已知0.4mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出256.65kJ的热量。
①写出肼和过氧化氢的电子式: 肼___________,过氧化氢___________ 。
②写出热化学方程式________________________。
③已知H2O(1)=H2O(g) △H=+44kJ/mol,则64g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是_________ kJ。
(2)NA表示阿伏加德罗常数,在CH4(g)完全燃烧生成CO2和液态水的反应中,每有
4NA个电子转移时,放出445kJ的热量。 _______________________________
(3)已知拆开1molN≡N键,1molH-H键,1molN-H键分别需要的能量是a kJ、b kJ、c kJ,则N2与H2反应生成NH3的热化学方程式为: ______________________________
(4)已知:
N2(g)+2O2(g)===2NO2(g) ΔH=+67.7 kJ/mol①
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-543 kJ/mol②
1/2H2(g)+1/2F2(g)===HF(g) ΔH=-269 kJ/mol③
H2(g)+1/2O2(g)===H2O(g) ΔH=-242 kJ/mol④
①写出肼(N2H4)和NO2反应的热化学方程式_____________________________________。
②有人认为若用氟气代替二氧化氮作氧化剂,则反应释放的能量更大,肼和氟气反应的热化学方程式为_________________________________。
(1)①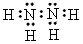 ;
;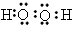 ;②N2H4(1)+2H2O2(1)=N2(g)+4H2O(g) △H=-641.625kJ/mol
;②N2H4(1)+2H2O2(1)=N2(g)+4H2O(g) △H=-641.625kJ/mol
③1635.25
(2)CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) △H= -890kJ/mol
(3)N2(g) + 3H2(g) = 2NH3(g) △H= -(6c- a-3b)kJ/mol
(4)2N2H4(g)+2NO2(g) ===3N2(g)+4H2O(g) ΔH=-1153.7 kJ/mol
N2H4(g)+2F2(g) ===N2(g)+4HF (g) ΔH=-1135 kJ/mol
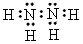 ;
;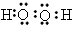 ;②N2H4(1)+2H2O2(1)=N2(g)+4H2O(g) △H=-641.625kJ/mol
;②N2H4(1)+2H2O2(1)=N2(g)+4H2O(g) △H=-641.625kJ/mol③1635.25
(2)CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) △H= -890kJ/mol
(3)N2(g) + 3H2(g) = 2NH3(g) △H= -(6c- a-3b)kJ/mol
(4)2N2H4(g)+2NO2(g) ===3N2(g)+4H2O(g) ΔH=-1153.7 kJ/mol
N2H4(g)+2F2(g) ===N2(g)+4HF (g) ΔH=-1135 kJ/mol

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

 SiCl4+2CO
SiCl4+2CO 海带灰
海带灰 浸泡液
浸泡液 I2(CCL4)→I2
I2(CCL4)→I2
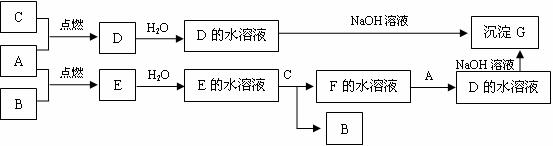
 SiCl4+2CO
SiCl4+2CO 海带灰
海带灰 浸泡液
浸泡液 I2(CCL4)→I2
I2(CCL4)→I2