题目内容
(1)1.5mol H2SO4的质量是______g,其中含有______mol H,含有______g氧元素.
(2)9.03×1023个氨分子含______ mol氨分子______ mol氢原子
(3)______mol CO2中含有12g碳.标况下,______L CO2中含有2mol 氧原子,它的质量是______g.
解:(1)1.5mol H2SO4的质量为:1.5mol×98g/mol=147g,由化学式可知H2SO4,H原子的物质的量是硫酸分子的2倍,即H原子物质的量为:1.5mol×2=3mol,氧原子的物质的量为硫酸分子的4倍,故O原子物质的量为:1.5mol×4=6mol,氧元素质量为6mol×16g/mol=96g;
故答案为:147;3;96;
(2)9.03×1023个氨分子的物质的量为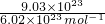 =1.5mol,由化学式NH3可知,H原子的物质的量是氨气分子的3倍,即H原子的物质的量为1.5mol×3=4.5mol;
=1.5mol,由化学式NH3可知,H原子的物质的量是氨气分子的3倍,即H原子的物质的量为1.5mol×3=4.5mol;
故答案为:1.5;4.5;
(3)12g碳的物质的量为 =1mol,根据碳原子守恒可知,二氧化碳的物质的量等于碳的物质的量为1mol,CO2中O原子的物质的量为CO2分子的2倍,故CO2的物质的量为
=1mol,根据碳原子守恒可知,二氧化碳的物质的量等于碳的物质的量为1mol,CO2中O原子的物质的量为CO2分子的2倍,故CO2的物质的量为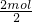 =1mol,CO2体积为1mol×22.4L/mol=22.4L,CO2的质量为1mol×44g/mol=44g,
=1mol,CO2体积为1mol×22.4L/mol=22.4L,CO2的质量为1mol×44g/mol=44g,
故答案为:1;22.4;44.
分析:(1)根据m=nM计算1.5mol H2SO4的质量,由化学式可知H2SO4,H原子的物质的量是硫酸分子的2倍,氧原子的物质的量为硫酸分子的4倍,再根据m=nM计算氧元素的质量;
(2)根据n= 计算氨气分子的物质的量,由化学式NH3可知,H原子的物质的量是氨气分子的3倍;
计算氨气分子的物质的量,由化学式NH3可知,H原子的物质的量是氨气分子的3倍;
(3)根据n= 计算碳的物质的量,根据碳原子守恒可知,二氧化碳的物质的量等于碳的物质的量,CO2中O原子的物质的量为CO2分子的2倍,据此计算CO2的物质的量,根据V=nVm计算CO2体积,根据m=nM计算CO2的质量.
计算碳的物质的量,根据碳原子守恒可知,二氧化碳的物质的量等于碳的物质的量,CO2中O原子的物质的量为CO2分子的2倍,据此计算CO2的物质的量,根据V=nVm计算CO2体积,根据m=nM计算CO2的质量.
点评:本题考查常用化学计量的有关计算,比较基础,注意公式的理解与灵活运用.
故答案为:147;3;96;
(2)9.03×1023个氨分子的物质的量为
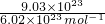 =1.5mol,由化学式NH3可知,H原子的物质的量是氨气分子的3倍,即H原子的物质的量为1.5mol×3=4.5mol;
=1.5mol,由化学式NH3可知,H原子的物质的量是氨气分子的3倍,即H原子的物质的量为1.5mol×3=4.5mol;故答案为:1.5;4.5;
(3)12g碳的物质的量为
 =1mol,根据碳原子守恒可知,二氧化碳的物质的量等于碳的物质的量为1mol,CO2中O原子的物质的量为CO2分子的2倍,故CO2的物质的量为
=1mol,根据碳原子守恒可知,二氧化碳的物质的量等于碳的物质的量为1mol,CO2中O原子的物质的量为CO2分子的2倍,故CO2的物质的量为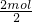 =1mol,CO2体积为1mol×22.4L/mol=22.4L,CO2的质量为1mol×44g/mol=44g,
=1mol,CO2体积为1mol×22.4L/mol=22.4L,CO2的质量为1mol×44g/mol=44g,故答案为:1;22.4;44.
分析:(1)根据m=nM计算1.5mol H2SO4的质量,由化学式可知H2SO4,H原子的物质的量是硫酸分子的2倍,氧原子的物质的量为硫酸分子的4倍,再根据m=nM计算氧元素的质量;
(2)根据n=
 计算氨气分子的物质的量,由化学式NH3可知,H原子的物质的量是氨气分子的3倍;
计算氨气分子的物质的量,由化学式NH3可知,H原子的物质的量是氨气分子的3倍;(3)根据n=
 计算碳的物质的量,根据碳原子守恒可知,二氧化碳的物质的量等于碳的物质的量,CO2中O原子的物质的量为CO2分子的2倍,据此计算CO2的物质的量,根据V=nVm计算CO2体积,根据m=nM计算CO2的质量.
计算碳的物质的量,根据碳原子守恒可知,二氧化碳的物质的量等于碳的物质的量,CO2中O原子的物质的量为CO2分子的2倍,据此计算CO2的物质的量,根据V=nVm计算CO2体积,根据m=nM计算CO2的质量.点评:本题考查常用化学计量的有关计算,比较基础,注意公式的理解与灵活运用.

练习册系列答案
相关题目
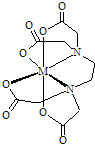 乙二胺四乙酸(EDTA)及其盐是常用于定量检测和分析金属离子的重要试剂.EDTA的阴离子可简写为Y4-,它与一些金属离子反应生成稳定的金属有机化合物离子:M2++Y4-=(MY)2-;M3++Y4-=(MY)-.
乙二胺四乙酸(EDTA)及其盐是常用于定量检测和分析金属离子的重要试剂.EDTA的阴离子可简写为Y4-,它与一些金属离子反应生成稳定的金属有机化合物离子:M2++Y4-=(MY)2-;M3++Y4-=(MY)-.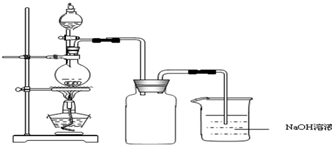 硫酸铜是一种应用极其广泛的化工原料.铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图所示).
硫酸铜是一种应用极其广泛的化工原料.铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图所示).