题目内容
9.图甲和图乙表示的是短周期部分或全部元素的某种性质的递变规律,下列说法正确的是( )
| A. | 图甲横坐标为原子序数,纵坐标表示元素的最高正价 | |
| B. | 图甲横坐标为核电荷数,纵坐标表示元素的原子半径(单位:pm) | |
| C. | 图乙横坐标为最高正价,纵坐标表示元素的原子半径(单位:pm) | |
| D. | 图乙横坐标为最外层电子数,纵坐标表示元素的原子半径(单位:pm) |
分析 A.稀有气体化合价为0,氧元素、氟元素没有最高正化合价;
B.同周期元素从左到右,主族元素原子半径逐渐减小;
C.氧元素、氟元素没有最高正化合价;
D.同周期自左而右,主族元素最外层电子数由1-7,原子半径依次减小.
解答 解:A.稀有气体化合价为0,氧元素、氟元素没有最高正化合价,图象中不符合,故A错误;
B.同周期元素从左到右,主族元素原子半径逐渐减小,与图象不符,故B错误;
C.氧元素、氟元素没有最高正化合价,图象中不符合,故C错误;
D.同周期自左而右,主族元素最外层电子数由1-7,原子半径依次减小,图象符合实际,故D正确.
故选D.
点评 本题考查元素周期表与周期律知识,侧重于学生的分析能力的考查,注意把握元素的性质的递变规律,难度不大.

练习册系列答案
相关题目
19.哈伯因发明了用氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖.现向一密闭容器中充入1molN2和3molH2,在一定条件下使该反应发生.下列说法正确的是( )
| A. | 达到化学平衡时,N2完全转化为NH3 | |
| B. | 达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 | |
| C. | 达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 | |
| D. | 达到化学平衡时,正反应和逆反应速率都为零 |
20.铅蓄电池是最常见的二次电池,其电池总反应可以表示为:Pb(s)+PbO2(s)+2H2SO4(aq)$?_{充电}^{放电}$2PbSO4(s)+2H2O(l),下列说法不正确的是( )
| A. | 电池的电解液为酸性溶液,正极为PbO2、负极为Pb | |
| B. | 电池放电时,正极反应为PbO2+2 e-+SO42-+4H+═PbSO4+2H2O | |
| C. | 电池充电过程中,阳极附近溶液的pH升高 | |
| D. | 电池充电时,阴极反应为PbSO4+2e-═Pb+SO42- |
4.下列能量转化过程中,由光能转变为化学能的是( )
| A. |  光伏发电 | B. |  风力发电 | C. |  光合作用 | D. | 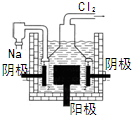 电解制钠 |
14.在探究乙醇的有关实验中,得出的结论正确的是( )
| 选项 | 实验步骤及现象 | 实验结论 |
| A | 在酒精试样中加入少量CuSO4•5H2O,搅拌,试管底部有蓝色晶体 | 酒精试样中一定含有水 |
| B | 在乙醇燃烧火焰上方罩一冷的干燥烧杯,内壁有水珠出现,另罩一内壁涂有澄清石灰水的烧杯,内壁出现白色沉淀 | 乙醇由C、H、O三种元素组成 |
| C | 在0.01mol金属钠中加入过量的乙醇充分反应,收集到标准状况下气体112mL | 乙醇分子中有1个氢原子与氧原子相连,其余与碳原子相连 |
| D | 将灼热后表面变黑的螺旋状铜丝伸入约50℃的乙醇中,铜丝能保持红热一段时间 | 乙醇催化氧化反应是放热反应 |
| A. | A | B. | B | C. | C | D. | D |
1.下列关于有机物性质的说法正确的是( )
| A. | 乙烯和甲烷都可以与氯气反应 | |
| B. | 乙烯和聚乙烯都能使溴水褪色 | |
| C. | 乙烯和苯都能使酸性高锰酸钾溶液褪色 | |
| D. | 乙酸能与钠产生氢气,而乙醇不可以 |
11.金刚石和石墨是碳元素的两种结构不同的单质.在100kPa时,1mol金刚石转化为石墨,要放出1.895KJ的热能.试判断在100kPa压强下,下列说法正确的是( )
| A. | 金刚石比石墨稳定 | |
| B. | 石墨转化为金刚石属于化学变化 | |
| C. | 1g石墨完全燃烧放出的热量比1g金刚石完全燃烧放出的热量多 | |
| D. | 等质量的石墨和金刚石中所含原子数前者多 |
12. 某同学利用家中废旧材料制作一个可使玩具扬声器发出声音的电池,装置如图所示.下列说法正确的是( )
某同学利用家中废旧材料制作一个可使玩具扬声器发出声音的电池,装置如图所示.下列说法正确的是( )
 某同学利用家中废旧材料制作一个可使玩具扬声器发出声音的电池,装置如图所示.下列说法正确的是( )
某同学利用家中废旧材料制作一个可使玩具扬声器发出声音的电池,装置如图所示.下列说法正确的是( )| A. | 电流方向为:铝质易拉罐→导线→扬声器→导线→炭棒 | |
| B. | 铝质易拉罐将逐渐得到保护 | |
| C. | 电池总反应为:4Al+3O2+6H2O═4Al(OH)3 | |
| D. | 炭棒上发生的主要反应为:2H++2e-═H2↑ |