题目内容
17.下表是元素周期表的一部分,其中已标出了①-⑨九种元素.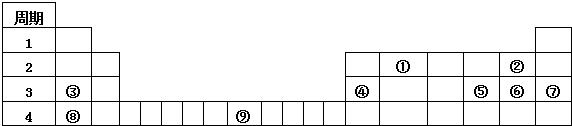
请用这九种元素回答下列问题:
(1)属于过渡元素的是⑨(用表中数字表示).
(2)金属性最强的元素是K(填元素符号).
(3)元素⑤形成的能使品红溶液褪色的氧化物与NaOH溶液反应的化学方程式为SO2+2NaOH=Na2SO3+H2O.
(4)写出元素③和元素⑥形成的化合物的电子式
 .
.
分析 由元素在周期表中位置,知①为C、②为F、③为Na、④为Al、⑤为S、⑥为Cl、⑦为Ar、⑧为K、⑨为Fe.
(1)上述元素中Fe元素属于过渡元素;
(2)同周期自左而右非金属性增强,同主族自上而下非金属性减弱;
(3)硫元素氧化物中二氧化硫具有漂白性,能使品红溶液褪色;
(4)元素③和元素⑥形成的化合物为NaCl,属于离子化合物,由钠离子与氯离子构成.
解答 解:由元素在周期表中位置,知①为C、②为F、③为Na、④为Al、⑤为S、⑥为Cl、⑦为Ar、⑧为K、⑨为Fe.
(1)上述元素中Fe元素属于过渡元素,故答案为:⑨;
(2)同周期自左而右非金属性增强,同主族自上而下非金属性减弱,故K元素金属性最强,故答案为:K;
(3)元素⑤是S,形成的能使品红溶液褪色的氧化物是SO2 与NaOH溶液反应的化学方程式为SO2+2NaOH=Na2SO3+H2O,故答案为:SO2+2NaOH=Na2SO3+H2O;
(4)元素③和元素⑥形成的化合物为NaCl,属于离子化合物,由钠离子与氯离子构成,其电子式为 ,故答案为:
,故答案为: .
.
点评 本题考查元素周期表及元素周期律,比较基础,侧重对基础知识的巩固.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
8.“纳米材料”是粒子直径为1-100nm的材料,纳米碳就是其中一种,若将纳米碳均匀地分散到蒸馏水中所形成的物质,下列说法正确的是( )①是溶液②种置后会析出黑色沉淀③能产生丁达尔效应④能透过滤纸⑤不能透过滤纸⑥是胶体.
| A. | ①④⑤ | B. | ③④⑥ | C. | ②③⑤ | D. | ②③⑥ |
12.下列有关食品添加剂的说法正确的是( )
| A. | 需要长时间储存的食品应加入适宜的防腐剂 | |
| B. | 冰激凌不使用着色剂营养价值一定会降低 | |
| C. | 色、香、味俱全的食物营养价值不一定高 | |
| D. | 炒菜时拒绝添加食盐、味精等各种调味剂 |
2.下列有关化学用语使用正确的是( )
| A. | 硫原子的结构示意图: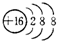 | |
| B. | ${\;}_{1}^{1}{H}_{2}$、${\;}_{1}^{2}$H2、${\;}_{1}^{3}{H}_{2}$是氢的三种同位素 | |
| C. | 原子核内有10个中子的氧原子${\;}_{8}^{18}O$ | |
| D. | 金刚石、石墨、甲烷属于同素异形体 |
9.等体积的下列溶液中,阳离子的总物质的量最大的是 ( )
| A. | 0.2mol•L-1的CuSO4溶液 | B. | 0.1mol•L-1的Na2CO3 | ||
| C. | 0.2mol•L-1的KCl | D. | 0.1mol•L-1的Na2SO4 |
7.已知:①2H2(g)+O2(g)═2H2O (g)△H=-483.6kJ•mol
②H+(aq)+OH-(aq)═H2O(1)△H=-57.3kJ•mol
下列说法中正确的是( )
②H+(aq)+OH-(aq)═H2O(1)△H=-57.3kJ•mol
下列说法中正确的是( )
| A. | 由①式可知H2的燃烧热为241.8kJ/mol | |
| B. | 2H2(g)+O2(g)=2H2O(1)△H>-483.6kJ/mol | |
| C. | 将含1mol NaOH的稀溶液与0.05mol浓硫酸溶液混合后放出的热量为57.3kJ | |
| D. | 将含1molBa(OH)2的稀溶液与含2mol HCl的稀溶液混合后放出的热量等于114.6kJ |
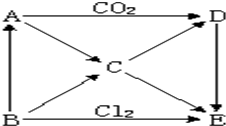 下图表示A~E五种物质间的相互转化关系,其中A为淡黄色固体,B为金属单质.试推出各物质的化学式,并写出有关反应的化学方程式.
下图表示A~E五种物质间的相互转化关系,其中A为淡黄色固体,B为金属单质.试推出各物质的化学式,并写出有关反应的化学方程式.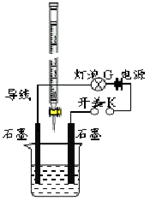 某温度下,水的离子积Kw=l×10-13.有酸溶液A,pH=a;碱溶液B,pH=b.为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置.
某温度下,水的离子积Kw=l×10-13.有酸溶液A,pH=a;碱溶液B,pH=b.为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置.