题目内容
有A、B、C三种透明、不溶于水的坚硬固体。A在O2中完全燃烧只得到一种无色气体,此气体的密度为O2密度的1.375倍(标准状况)。B能溶于热烧碱溶液中,再往该溶液中加入过量盐酸时,析出白色胶状沉淀,它是一种比碳酸还弱的酸,分离出此沉淀物,经干燥后得到不溶于水的白色粉末,将B与石灰石、纯碱按一定比例混合高温烧熔、冷却得C,C在高温下软化,无固定熔点。根据以上事实,推断:
(1)A是________,B是________,C是________。
(2)写出有关反应的化学方程式________________________________。
(1)A是________,B是________,C是________。
(2)写出有关反应的化学方程式________________________________。
(1)金刚石晶体 二氧化硅晶体 玻璃
(2)C+O2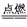 CO2 SiO2+2NaOH
CO2 SiO2+2NaOH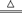 Na2SiO3+H2O
Na2SiO3+H2O
Na2SiO3+2HCl H2SiO3↓+2NaCl
H2SiO3↓+2NaCl
CaCO3+SiO2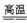 CaSiO3+CO2↑
CaSiO3+CO2↑
Na2CO3+SiO2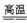 Na2SiO3+CO2↑
Na2SiO3+CO2↑
(2)C+O2
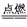 CO2 SiO2+2NaOH
CO2 SiO2+2NaOH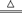 Na2SiO3+H2O
Na2SiO3+H2ONa2SiO3+2HCl
 H2SiO3↓+2NaCl
H2SiO3↓+2NaClCaCO3+SiO2
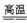 CaSiO3+CO2↑
CaSiO3+CO2↑Na2CO3+SiO2
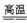 Na2SiO3+CO2↑
Na2SiO3+CO2↑ A完全燃烧所得气体的相对分子质量为:32×1.375=44,即该气体为CO2,A为C元素的单质,依A的性能知A为金刚石,依据B的性质及所发生的一系列反应和反应产物的性质推知B为SiO2晶体,则C为玻璃。

练习册系列答案
相关题目