题目内容
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:

(1)石墨电极(C)作________极,甲中甲烷燃料电池的负极反应式为______________________________。
(2)若消耗2.24 L(标况)氧气,则乙装置中铁电极上生成的气体体积(标况)为________ L。
(3)丙中以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、An等杂质)的电解精炼。下列说法正确的是________(填字母)。
A.a电极为纯铜
B.粗铜接电源正极,发生还原反应
C.CuSO4溶液的浓度保持不变
D.利用阳极泥可回收Ag、Pt、Au等金属
(4)若丙中以稀H2SO4为电解质溶液,电极材料b为铝,则能使铝表面生成一层致密的氧化膜,该电极反应式为__________________________________________________________。
【答案】 阳 CH4+10OH--8e-===CO![]() +7H2O 4.48 AD 2Al+3H2O-6e-===Al2O3 + 6H+
+7H2O 4.48 AD 2Al+3H2O-6e-===Al2O3 + 6H+
【解析】(1)燃料电池中,负极上投放燃料,所以投放甲烷的电极是负极,则乙池中铁为阴极,C为阳极;负极上失电子发生氧化反应,电极反应式为:CH4+10 OH--8e-=CO32-+7H2O.
故答案为:阳;CH4-8e-+10 OH-═CO32-+7H2O;
(2)串联电池中转移电子数相等,若在标准状况下,有2.24L氧气参加反应,则转移电子的物质的量=![]() ×4=0.4mol,乙装置中铁电极上氢离子放电生成氢气,设生成氢气的体积为xL;
×4=0.4mol,乙装置中铁电极上氢离子放电生成氢气,设生成氢气的体积为xL;
2H++2e-=H2↑
2mol 22.4L
0.4mol xL
x=4.48,故答案为:4.48;
(3)电解精炼铜时利用了电解原理,电能转化为化学能,也有少量转化为热能;电解精炼时粗铜做阳极,发生氧化反应,精铜做阴极,阴极上发生还原反应;电解时,溶液中的阳离子发生变化,铜离子浓度逐渐减小,锌离子等浓度逐渐增大;粗铜中的不活泼金属不能失电子,以阳极泥的形式沉积在阳极附近,故答案为AD;
(4)电解池的阳极材料是铝时,则该电极反应是铝本身失电子的过程,即2Al+3H2O-6e-=Al2O3+6H+,阴极发生阳离子的得电子过程,在酸溶液中,为6H++6e-=3H2,故答案为:2Al+3H2O-6e-=Al2O3+6H+。

 备战中考寒假系列答案
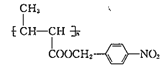
备战中考寒假系列答案【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次(从左至右)发生的反应类型和反应条件都正确的是( )
选项 | 反应类型 | 反应条件 |
A | 加成反应、取代反应、消去反应 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
B | 消去反应、加成反应、取代反应 | NaOH醇溶液/加热、常温、NaOH水溶液/加热 |
C | 氧化反应、取代反应、消去反应 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
D | 消去反应、加成反应、水解反应 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
A. A B. B C. C D. D