��Ŀ����
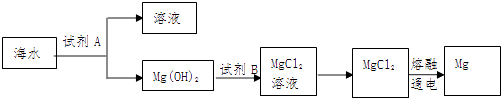
����Ŀ��������������Խ������Ϊ��������֮�������������������ҵ�����ѿ�ʯ(��Ҫ�ɷ�:FeO��TiO2��SiO2��)Ϊԭ����ȡ�Ѳ��õ��������̷�(FeSO4��7H2O)�������������£��ش��������⣺

��֪:��TiO2(s)+H2SO4(aq)=TiOSO4(aq)+H2O(l)
��TiO2+��ˮ�⣬ֻ�ܴ�����ǿ������Һ��
��1���ѿ�ʯ�ڼ���Ũ��������ǰҪ�ȷ��飬��Ŀ����_____________��
��2������������۵�Ŀ����_____________��
��3������2����Ҫ�ɷ���_____________��
��4�����û�ѧƽ���ƶ�ԭ��������Һ2������е�Ŀ��_____________��
��5���ڸ����£�TiO2�ͽ�̿�Ļ������ͨ��Cl2�õ�TiC14��һ�ֿ�ȼ�����壬��д����Ӧ�Ļ�ѧ����ʽ_____________��
���𰸡� ����Ӵ���������ٹ����ܽ� ��Fe3+��ԭΪFe2+ FeSO4��7H2O TiO2+��ˮ��Ϊ���ȷ�Ӧ���¶�����ƽ�������ƶ�������������H2TiO3 TiO2+2C+2Cl2![]() TiCl4+2CO
TiCl4+2CO
��������������Ҫ������ڡ���ҵ�����ѿ�ʯΪԭ����ȡ�Ѳ��õ��������̷�(FeSO4��7H2O)�������̡������ۡ�
��1���ѿ�ʯ�ڼ���Ũ��������ǰҪ�ȷ��飬��Ŀ��������Ӵ���������ٹ����ܽ⡣
��2��2Fe3+��Fe![]() 3Fe2+������������۵�Ŀ���ǽ�Fe3+��ԭΪFe2+��
3Fe2+������������۵�Ŀ���ǽ�Fe3+��ԭΪFe2+��
��3���̷��ܽ�������¶Ƚ��Ͷ���С����Һ1��ȴ�õ�����2����Ҫ�ɷ���FeSO4��7H2O��
��4���û�ѧƽ���ƶ�ԭ��������Һ2������е�Ŀ����TiO2+��ˮ��Ϊ���ȷ�Ӧ���¶�����ƽ�������ƶ�������������H2TiO3��
��5���ڸ����£�TiO2�ͽ�̿�Ļ������ͨ��Cl2�õ�TiC14��һ�ֿ�ȼ�����壬��Ӧ�Ļ�ѧ����ʽΪTiO2+2C+2Cl2![]() TiCl4+2CO��
TiCl4+2CO��

 С��ſ�ʱ��ҵϵ�д�
С��ſ�ʱ��ҵϵ�д� һ������ϵ�д�
һ������ϵ�д� �Ƹ�С״Ԫ���ֳ������ϵ�д�
�Ƹ�С״Ԫ���ֳ������ϵ�д� �¸��̵�ѧϵ�д�
�¸��̵�ѧϵ�д� ����ͬѧһ����ʦȫ�źþ�ϵ�д�
����ͬѧһ����ʦȫ�źþ�ϵ�д�