题目内容
【题目】分析以下几个热化学方程式,哪个是表示固态碳和气态氢气燃烧时的燃烧热的是( )
A.C(s)+O2(g)═CO(g)△H=﹣110.5 kJ/mol
B.C(s)+O2(g)═CO2(g)△H=﹣393.5 kJ/mol
C.2H2(g)+O2(g)═2H2O(l)△H=﹣571.6 kJ/mol
D.H2(g)+ ![]() ?O2(g)═H2O(g)△H=﹣241.8 kJ/mol
?O2(g)═H2O(g)△H=﹣241.8 kJ/mol
【答案】B
【解析】解:A.C燃烧生成的稳定氧化物是CO2不是CO,所以不符合燃烧热的概念要求,故A错误; B.1molC完全燃烧生成稳定的CO2 , 符合燃烧热的概念要求,放出的热量为燃烧热,故B正确;
C.燃烧热是指1mol纯净物完全燃烧,方程式中为2mol,不是燃烧热,故C错误;
D.生成稳定的氧化物,水应为液态,故D错误.
故选B.
【考点精析】利用燃烧热对题目进行判断即可得到答案,需要熟知在101kPa时1mol H2物质完全燃烧生成稳定的氧化物时所放出的能量,叫该物质的燃烧热.

【题目】氮的固定是几百年来科学家一直研究的课题.
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值.
反应 | 大气固氮 | 工业固氮 | |||
温度/℃ | 27 | 2000 | 25 | 400 | 450 |
K | 3.84×10﹣31 | 0.1 | 5×108 | 0.507 | 0.152 |
①分析数据可知:大气固氮反应属于(填“吸热”或“放热”)反应
②分析数据可知:人类不适合大规模模拟大气固氮原因
③从平衡角度考虑.工业固氮应该选择常温条件,但实际工业产生却选择500℃左右的高温,解释其原因
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,如图所示的图示中,正确的是(填“A”或“B”);比较р1、р2的大小关系 . 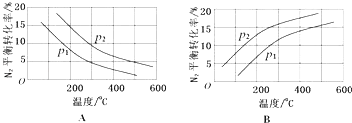
(3)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1)4NH3(g)+3O2(g),则其反应热△H= . 已知:N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1
2H2(g)+O2(g)2H2O(l)△H=﹣571.6kJmol﹣1 .


