题目内容
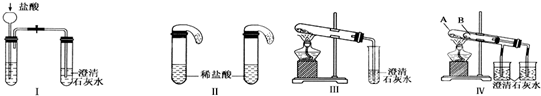
某校化学课外小组为了鉴别碳酸钠和酸钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ.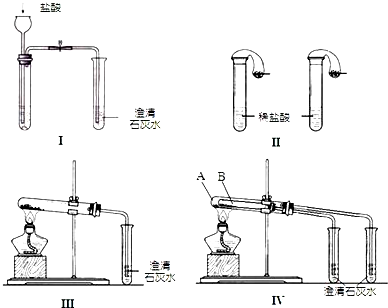
(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的是(填装置序号)
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式为
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是
(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应.当碳酸氢钠与氢氧化钙物质的量之比为2:1时,所得溶液中溶质的化学式为
(5)另有两瓶溶液,已知分别是K2CO3和NaHCO3,请你写出两种不同的鉴别方法.
①
分析:(1)实验Ⅰ中,无论碳酸钠还是碳酸氢钠都能和盐酸反应生成二氧化碳,二氧化碳能使澄清的石灰水变浑浊;碳酸钠和盐酸反应分两步进行,盐酸和碳酸钠、碳酸氢钠反应都生成二氧化碳,二氧化碳能使澄清的石灰水变浑浊;
(2)碳酸氢钠不稳定,在加热条件下能分解生成碳酸钠、二氧化碳和水,碳酸钠较稳定,加热不易分解;Ⅳ可以做到用一套装置同时进行两个对比实验,具有较强的对照性;
(3)B加热温度较低,可将碳酸氢钠在较低温度下加热,不直接加热碳酸氢钠就能分解更说明碳酸氢钠不稳定;
(4)碳酸氢钠和氢氧化钙发生复分解反应,结合物质的量关系书写方程式;
(5)可用焰色反应鉴别,也可用氯化钙溶液鉴别.
(2)碳酸氢钠不稳定,在加热条件下能分解生成碳酸钠、二氧化碳和水,碳酸钠较稳定,加热不易分解;Ⅳ可以做到用一套装置同时进行两个对比实验,具有较强的对照性;
(3)B加热温度较低,可将碳酸氢钠在较低温度下加热,不直接加热碳酸氢钠就能分解更说明碳酸氢钠不稳定;
(4)碳酸氢钠和氢氧化钙发生复分解反应,结合物质的量关系书写方程式;
(5)可用焰色反应鉴别,也可用氯化钙溶液鉴别.
解答:解:(1)Ⅰ装置反应现象相同;Ⅱ装置,向碳酸钠溶液中滴加盐酸先没有气体生成,随着盐酸的不断滴加,后产生气泡,向碳酸氢钠溶液中滴加盐酸立即产生气泡,所以能够达到实验目的是Ⅱ,
故答案为:Ⅱ;
(2)碳酸氢钠在加热条件下能分解生成碳酸钠、水和二氧化碳2NaHCO3
Na2CO3+H2O+CO2↑,图Ⅳ不仅能鉴别碳酸钠和碳酸氢钠,同时又能验证碳酸钠和碳酸氢钠的稳定性,Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行,
故答案为:2NaHCO3
Na2CO3+H2O+CO2↑;Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行;
(3)碳酸钠直接加热,碳酸氢钠不直接加热,不直接加热的碳酸氢钠能分解而直接加热的碳酸钠不分解更能说明碳酸氢钠不稳定,故答案为:NaHCO3;
(4)碳酸氢钠与氢氧化钙的物质的量之比为2:1时,反应方程式为2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2O,溶质为Na2CO3,故答案为:Na2CO3;
(5)钠、钾的焰色反应现象不同,可用焰色反应鉴别,也可用氯化钙溶液鉴别,加入氯化钙溶液,变浑浊的是碳酸钠,
故答案为:焰色反应;加入氯化钙溶液,变浑浊的是碳酸钠.
故答案为:Ⅱ;
(2)碳酸氢钠在加热条件下能分解生成碳酸钠、水和二氧化碳2NaHCO3
| ||
故答案为:2NaHCO3
| ||
(3)碳酸钠直接加热,碳酸氢钠不直接加热,不直接加热的碳酸氢钠能分解而直接加热的碳酸钠不分解更能说明碳酸氢钠不稳定,故答案为:NaHCO3;
(4)碳酸氢钠与氢氧化钙的物质的量之比为2:1时,反应方程式为2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2O,溶质为Na2CO3,故答案为:Na2CO3;
(5)钠、钾的焰色反应现象不同,可用焰色反应鉴别,也可用氯化钙溶液鉴别,加入氯化钙溶液,变浑浊的是碳酸钠,
故答案为:焰色反应;加入氯化钙溶液,变浑浊的是碳酸钠.
点评:本题考查了碳酸钠和碳酸氢钠的性质,注意装置与物质性质的关系,明确碳酸钠和盐酸反应分两步进行为解答的关键,侧重二者与酸的反应及稳定性比较的考查,题目难度不大.

练习册系列答案
相关题目
 某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示.
某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示.