题目内容
某烃类物质0.1mol完全燃烧,将生成物通过浓硫酸,浓硫酸增重7.2克,再将剩余气体通过碱石灰,碱石灰增重13.2克,通过计算,
(1)确定该有机物的最简式
(2)确定该有机物的分子式,写出其结构简式。
(3)该烃标态下对氢气的相对密度为多少
方法1.设此烃为CXHY.
CXHY + (X+4/Y) O2→XCO2+2/YH2O
1 X+4/Y X 2/Y
0.1 0.3 0.4
X=3 Y=8
方法2. n(C)= n(CO2)=13.2/44=0.3mol
n(H)="2" n(H2O)=2×7.2/18=0.8mol
n(C) :n(H)=3:8
此烃最简式为C3H8,即此烃为C3H8结构简式为CH3CH2CH3,
标准状况下对氢气的相对密度D= M(C3H8)/M(H2)=(12×3+1×8)/2=22
解析试题分析:分析题意:某烃类物质0.1mol完全燃烧,浓硫酸增重7.2克,说明生成7.2gH2O;再将剩余气体通过碱石灰,碱石灰增重13.2克,说明二氧化碳的质量是13.2g。所以可计算出水和二氧化碳的物质的量分别为0.4mol、0.3mol,所以1mol该烃分子中含有3molC、8molH,则该烃的分子式为C3H8;最简式也是C3H8;或者计算二氧化碳与水中的C、H原子个数比,得最简式C3H8;碳原子已经饱和,所以最简式也是分子式。结构简式为CH3CH2CH3,根据相对密度定义,计算出标态下对氢气的相对密度是D=M(C3H8)/M(H2)=22.
考点:考查对最简式、分子式、结构简式的判断,相对密度的计算

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案已知某醇燃料含有碳、氢、氧三种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如下表所列的实验结果(假设产生的气体完全被吸收):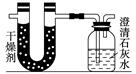
| | 实验前 | 实验后 |
| (干燥剂+U形管)的质量 | 101.1 g | 102.9 g |
| (石灰水+广口瓶)的质量 | 312.0 g | 314.2 g |
根据实验数据求:
(1)实验完毕后,生成物中水的质量为________ g,
假设广口瓶里生成一种正盐,其质量为________ g;
(2)生成的水中氢元素的质量为________ g;
(3)生成的二氧化碳中碳元素的质量为________ g;
(4)该燃料中碳元素与氢元素的质量比为________;
(5)已知这种醇的每个分子中含有一个氧原子,则该醇的分子式为__________,结构简式为_______________________________。
下列过程前者属于物理变化,后者属于化学变化的是
| A.碳酸钠晶体的风化、硫酸铜检验水 |
| B.煤的干馏、石油的裂化 |
| C.碘的升华、熔融的氯化镁导电 |
| D.煤的气化、用浸泡过高锰酸钾溶液的硅藻土保鲜水果 |


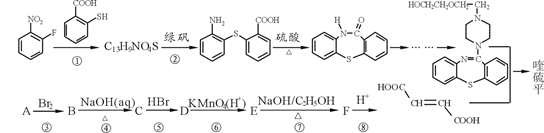
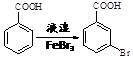 。写出以
。写出以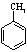 为原料制备
为原料制备 的合成路线流程图(无机试剂任选,可利用本题中的相关信息)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任选,可利用本题中的相关信息)。合成路线流程图示例如下: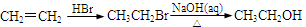 。
。 ,它可通过不同化学反应分别制得B、C和D三种物质.
,它可通过不同化学反应分别制得B、C和D三种物质.