题目内容
6.弱酸、弱碱的电离程度可以分别用它们的电离常数(K)或电离度(α)表示,请根据下列情景列式计算.(1)乙酰水杨酸是一种一元弱酸(可用HA表示).在一定温度下,0.1mol•L-1的乙酰水杨酸的水溶液中,乙酰水杨酸的电离常数K(HA)为3.4×10-4,求该酸的电离度.6%
(2)已知在25℃时,1mol•L-1氨水中NH3•H2O的电离度为0.42%,求NH3•H2O的电离常数K(NH3•H2O).
1.76×10-5.
分析 (1)设初始浓度为0.1mol/L的HA的电离度约x,则电离平衡时c(H+)、c(A-)的浓度为xmol/L,c(HA)为(0.1-x)mol/L,代入平衡常数表达式计算即可;
(2)根据电离度求出铵根离子浓度和氢氧根离子浓度,再根据K=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$计算.
解答 解:(1)设初始浓度为0.1mol/L的HA的电离度约x,则电离平衡时c(H+)、c(A-)的浓度为xmol/L,c(HA)为(0.1-x)mol/L,则
K=$\frac{c({H}^{+})•c({A}^{-})}{c(HA)}$=$\frac{{x}^{2}}{0.1-x}$=3.4×10-4 解得:x=0.06=6%,
故答案为:6%;
(2已知在25℃时,1mol•L-1氨水中NH3•H2O的电离度为0.42%,则c(NH4+)=c(OH-)=0.0042mol•L-1,
则K=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{0.0042×0.0042}{0.1-0.0042}$=1.76×10-5;
故答案为:1.76×10-5.
点评 本题考查了电离度、弱电解质的电离平衡常数,侧重于考查学生对电离度和平衡常数的计算的熟练程度,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.下表是某地区市场上销售的一种“加碘食盐”包装袋上的部分文字说明.
该加碘食盐中添加的是KIO3(填化学式),根据图表中信息,可推测该添加物在受热时容易分解.
| 配料表 | 精制海盐.碘酸钾 |
| 含碘量 | 20~40mg/kg |
| 卫生许可证号 | ××卫碘字(2007)第005号 |
| 分装日期 | 见封底 |
| 储藏方法 | 密封.避光.防潮 |
| 食用方法 | 烹调时,待食品熟后加入碘盐 |
14.下列有关反应速率的说法中,正确的是( )
| A. | 合成氨过程是一个放热反应,所以升高温度,反应速率反而减小 | |
| B. | 等质量的镁粉和镁条与同体积、同浓度的稀硫酸作用,其反应速率相等 | |
| C. | 铝片与硫酸溶液反应可产生氢气,常温下用98%的浓硫酸可以加快生成氢气的速率 | |
| D. | 同温同体积时,浓度大的草酸溶液比浓度较小的使酸化高锰酸钾溶液褪色速度快 |
1.下列有关电解池的叙述不合理的是( )
| A. | 高温电解熔融氯化钠时,阴极得金属钠、阳极得氯气 | |
| B. | 工业电解饱和食盐水时,阴极区生成烧碱溶液和氢气、阳极得氯气 | |
| C. | 实验室用碳棒作电极电解氯化铜溶液时,在阴、阳极分别得到氯气和铜 | |
| D. | 镀锌时将两极材料浸入含锌离子的电解液中,锌棒接电源正极,待镀件接电源负极 |
11.下列电离方程式中,正确的是( )
| A. | H2O+H2O?H3O++OH- | B. | Cu(NO3)2═Cu2++NO3- | ||
| C. | H2CO3?2H++CO32- | D. | NaOH?Na++OH- |
18.下列变化属于不加成反应的是( )
| A. | 乙烯通入酸性高锰酸钾溶液 | B. | 乙烯通入溴水中 | ||
| C. | 乙烯在一定条件下与氢气反应 | D. | 乙烯与氯化氢在一定条件下反应 |
16.化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式为C8H8O2.A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,A分子中只含一个苯环且苯环上只有一个取代基,其核磁共振氢谱与红外光谱如图.关于A的下列说法中,正确的是( )
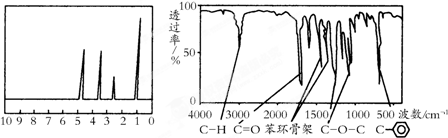

| A. | A分子属于酯类化合物,在一定条件下能发生水解反应 | |
| B. | A在一定条件下可与4 mol H2发生加成反应 | |
| C. | 符合题中A分子结构特征的有机物不止1种 | |
| D. | 与A属于同类化合物的同分异构体只有2种 |
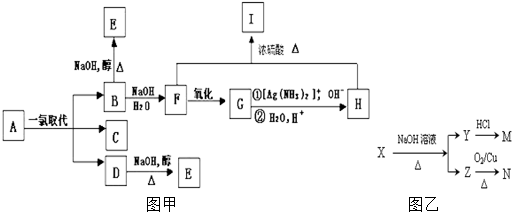
 铝是地壳中含量最高的金属元素,铝及其化合物在生产生活中的应用日趋广泛.
铝是地壳中含量最高的金属元素,铝及其化合物在生产生活中的应用日趋广泛. .
.