题目内容
【题目】某同学在常温下设计如下实验流程探究Na2S2O3的化学性质。
pH=8![]()
![]()
![]()
![]()
(1)实验①可说明________(填字母)。
a.该Na2S2O3溶液中水电离的c(OH-)=10-8mol·L-1
b.H2S2O3是一种弱酸
c.Na2S2O3是一种弱电解质
d.Na2S2O3的水解方程式为S2O![]() +2H2OH2S2O3+2OH-
+2H2OH2S2O3+2OH-
(2)写出实验②发生反应的离子方程式:_____________________________。
(3)Na2S2O3溶液中加入盐酸有淡黄色沉淀和刺激性气味的气体生成,写出该反应的离子方程式:_________________________________。
(4)实验室制得的Na2S2O3·5H2O粗产品中往往含有少量杂质。为了测定粗产品中Na2S2O3·5H2O的含量,一般在酸性条件下用KMnO4标准溶液滴定(假设粗产品中杂质与酸性KMnO4溶液不反应)。称取1.28 g粗样品溶于水,用0.40 mol·L-1 KMnO4标准溶液(加入适量硫酸酸化)滴定,当溶液中S2O![]() 全部被氧化时,消耗KMnO4溶液体积20.00 mL(5S2O
全部被氧化时,消耗KMnO4溶液体积20.00 mL(5S2O![]() +8MnO
+8MnO![]() +14H+===8Mn2++10SO
+14H+===8Mn2++10SO![]() +7H2O)。试回答:
+7H2O)。试回答:
①此滴定实验是否需要指示剂?_______(填“是”或“否”)。KMnO4溶液置于________(填“酸式”或“碱式”)滴定管中。
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果________(填“偏高”“偏低”或“不变”)。
③产品中Na2S2O3·5H2O的质量分数为___________________。
【答案】(1)b
(2)S2O![]() +5H2O+4Cl2+2Ba2+===2BaSO4↓+8Cl-+10H+
+5H2O+4Cl2+2Ba2+===2BaSO4↓+8Cl-+10H+
(3)S2O![]() +2H+===SO2↑+S↓+H2O
+2H+===SO2↑+S↓+H2O
(4)①否 酸式 ②偏低 ③96.9%
【解析】(1)pH=8的Na2S2O3溶液中,c(H2O)电离=c(OH-)=10-6mol·L-1,a项错误;Na2S2O3是强电解质,在水中完全电离,c项错误;Na2S2O3的水解方程式为S2O![]() +H2OHS2O
+H2OHS2O![]() +OH-、HS2O
+OH-、HS2O![]() +H2OH2S2O3+OH-,d项错误;由实验①可知Na2S2O3溶液显碱性,所以H2S2O3是一种弱酸,b项正确。(3)Na2S2O3在酸性条件下,自身发生氧化还原反应:S2O
+H2OH2S2O3+OH-,d项错误;由实验①可知Na2S2O3溶液显碱性,所以H2S2O3是一种弱酸,b项正确。(3)Na2S2O3在酸性条件下,自身发生氧化还原反应:S2O![]() +2H+===SO2↑+S↓+H2O。(4)①因为高锰酸钾本身有颜色,反应完颜色消失,所以不需要指示剂,高锰酸钾溶液应盛放在酸式滴定管中。②滴定时振荡不充分,刚看到溶液局部变色就停止滴定,说明加的高锰酸钾少了,会使样品中Na2S2O3·5H2O的质量分数的测定结果偏低。③设产品中Na2S2O3·5H2O的质量分数为w,有
+2H+===SO2↑+S↓+H2O。(4)①因为高锰酸钾本身有颜色,反应完颜色消失,所以不需要指示剂,高锰酸钾溶液应盛放在酸式滴定管中。②滴定时振荡不充分,刚看到溶液局部变色就停止滴定,说明加的高锰酸钾少了,会使样品中Na2S2O3·5H2O的质量分数的测定结果偏低。③设产品中Na2S2O3·5H2O的质量分数为w,有
5S2O![]() +8MnO
+8MnO![]() +14H+===8Mn2++10SO
+14H+===8Mn2++10SO![]() +7H2O
+7H2O
5 8
![]() 0.4 mol·L-1×0.02 L
0.4 mol·L-1×0.02 L
则有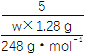 =
=![]() ,
,
解得,w=96.9%。

 阅读快车系列答案
阅读快车系列答案【题目】请参考题中图表,已知E1=134 kJ·mol-1、E2=368 kJ·mol-1,根据要求回答问题:
(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是__________(填“增大”、“减小”或“不变”,下同),ΔH的变化是__________。请写出NO2和CO反应的热化学方程式___________________。

(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)==CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+![]() O2(g)==CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)==CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
且H2O(g)==H2O(l) ΔH=-44 kJ·mol-1,则甲醇蒸汽燃烧为液态水的热化学方程式为_______________。
(3)如表所示是部分化学键的键能参数:
化学键 | P—P | P—O | O===O | P===O |
键能/kJ·mol-1 | a | b | c | x |

已知白磷的燃烧热为d kJ·mol-1,白磷及其完全燃烧的产物的结构如图Ⅱ所示,则表中x=__________ kJ·mol-1(用含a、b、c、d的代表数式表示)。