题目内容
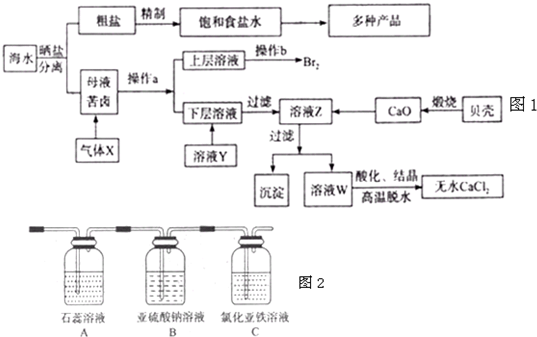
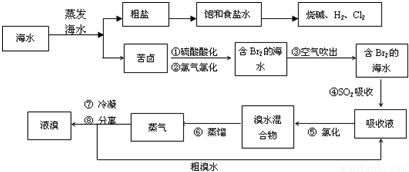
海水是应用前景广阔的化工原料资源,从海水中可提取各种化工原料.如图是工业上对海水的几项综合利用的示意图(已知气体X为电解饱和食盐水所得;母液苦卤中主要含有Ca2+、Mg2+,Cl-,SO42-、Br-等离子)请回答:
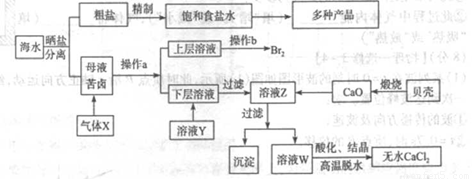
(1)在粗盐中含有Ca2+、Mg2+、SO42-等杂质,梢制时所用的试剂为:A.盐酸B.氯化钡溶液C.氢氧化钠溶液D.碳酸钠溶液,则加入试剂的顺序是(填编号)______
(2)气体X的化学式为______,操作a所用的主要仪器是______。
(3)加入溶液Y的目的是______,用CaO调节溶液Z的pH,可以除去Mg2+得到溶液W。由表中数据可知,理论上可选择pH最大范围是______。酸化溶液W时,使用的试剂为______
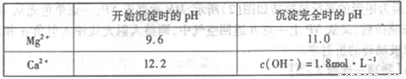
(4)将气体X依次通过下列装置以验证气体X的性质:
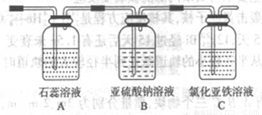
①通入气体X后,A中出现的现象是____________
②C装置中发生反应的离子方程式为____________。
③请你帮该小组同学设计一个实验,证明洗气瓶B中的Na2SO3已被氧化(简述实验步骤)
________________________________________________________________________
(16分)
(1)CBDA或BCDA(2分)
(2)Cl2(1分);分液漏斗(1分)
(3)除去SO42-,防止生成CaSO4的沉淀(2分);11.0≦pH≦12.2(2分);盐酸(2分)
(4)①溶液由紫色先变红,最后变为无色(2分);②2Fe2++Cl2=2Fe3++2Cl-(2分);
③取少量溶液于洁净的试管中,向其中滴加稀盐酸至不再产生气体,再向其中滴加氯化钡溶液,若产生白色沉淀,则证明亚硫酸钠已被氧化。(2分)
【解析】
试题分析:
(1)碳酸钠溶液除去氯化钡溶液过量引入的Ba2+,所以碳酸钠在氯化钡后面加入;盐酸用于除去过量的氢氧化钠、碳酸钠所以在最后,因此CBDA或BCDA均可。
(2)先用Cl2把海水中Br-氧化为Br2;从水中分离出Br2常用萃取的方法,使用分液漏斗。
(3)为了制的较纯的的产品,此步应该除去SO2-4,防止生成CaSO4的沉淀;11.0≦pH≦12.2的范围内Mg2+沉淀完全,而Ca2+不会沉淀;溶液中有Cl-,用盐酸不会引入新的杂质。
(4)①Cl2+H2O HCl+HClO,HCl使溶液由紫色先变红,HClO使溶液最后变为无色。②氯气与氯化亚铁反应:2Fe2++Cl2=2Fe3++2Cl-
HCl+HClO,HCl使溶液由紫色先变红,HClO使溶液最后变为无色。②氯气与氯化亚铁反应:2Fe2++Cl2=2Fe3++2Cl-
(5)Na2SO3被氧化,则溶液中有SO42-,向其中滴加稀盐酸至不再产生气体,再向其中滴加氯化钡溶液,若产生白色沉淀,则证明亚硫酸钠已被氧化。
考点:考查化学实验的设计、操作、化学计算等相关知识。


(1)在粗盐中含有Ca2+、Mg2+、SO42-等杂质,梢制时所用的试剂为:A.盐酸B.氯化钡溶 液C.氢氧化钠溶液D.碳酸钠溶液,则加入试剂的顺序是(填编号)______.
(2)气体X的化学式为______,操作a所用的主要仪器是______.
(3)加入溶液Y的目的是______,用CaO调节溶液Z的pH,可以除去Mg2+得到溶液W.由表中数据可知,理论上可选择pH最大范围是______.酸化溶液W时,使用的试剂为______.
| 开始沉淀时的pH | 沉淀完全时的pH | |
| Mg2+ | 9.6 | 11.0 |
| Ca2+ | 12.2 | c(OH-)=1.8mol?L-1 |
①通入气体X后,A中出现的现象是______.
②C装置中发生反应的离子方程式为______.
③请你帮该小组同学设计一个实验,证明洗气瓶B中的Na2SO3已被氧化(简述实验步骤)______.