题目内容
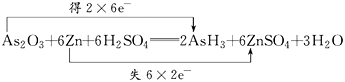
【题目】已知砒霜As2O3与Zn可以发生如下反应:As2O3+6Zn+6H2SO4=2AsH3+6ZnSO4+3H2O
(1)请用“双线桥法”标出电子转移的方向和数目:。
(2)As2O3在上述反应中________。
A.被氧化
B.被还原
C.既被氧化又被还原
D.既未被氧化又未被还原
(3)该反应的氧化产物是 , 氧化剂是。
(4)若生成0.1 mol AsH3 , 则转移的电子数为。(用NA表示)
【答案】
(1)
(2)B
(3)ZnSO4,As2O3
(4)0.6NA
【解析】(1)反应中,每个Zn原子失去2个电子,2个As原子得到12个电子,根据电子守恒,转移电子是12,则双线桥法标出电子转移的方向和数目为  。
。
(2)As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O中,As元素的化合价降低,则As2O3为氧化剂,表现氧化性,被还原,故选B。
(3)As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O中中,As元素的化合价降低,则As2O3为氧化剂,被还原,Zn是还原剂,被氧化,氧化产物为ZnSO4;
(4)As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O中生成2molAsH3转移12mol电子,则生成0.1molAsH3,则转移的电子数为0.6mol电子,即转移的电子数为0.6NA。

 优加精卷系列答案
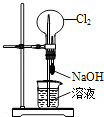
优加精卷系列答案【题目】无水AlCl3是一种重要的化工原料.某课外探究小组尝试制取无水AlCl3 , 查阅资料获得下列信息:无水AlCl3在178℃升华,极易潮解,遇水蒸气产生白色烟雾.
探究一 无水AlCl3的实验室制备
利用如图装置,用干燥、纯净的氯气在加热条件下与铝粉(已除去氧化膜)反应制取无水AlCl3 . 供选择的药品:①铝粉 ②浓硫酸 ③稀盐酸 ④饱和食盐水 ⑤二氧化锰粉末 ⑥无水氯化钙 ⑦稀硫酸 ⑧浓盐酸 ⑨氢氧化钠溶液
(1)写出装置A烧瓶中发生的反应方程式 .
(2)实验开始前,先检查装置气密性,后装入药品,接下来的步骤依次是(填序号)
a.加热D中硬质玻璃管 b.往A烧瓶中加入液体 c.点燃A中的酒精灯
(3)写出无水AlCl3与水蒸气反应的化学方程式 .
探究二 无水AlCl3的含量测定及结果分析
取D中反应后所得固体2.0g,与足量氢氧化钠溶液反应,测定生成气体的体积(体积均换算成标准状况),重复测定三次,数据如表:
第一次实验 | 第二次实验 | 第三次实验 | |
D中固体用量 | 2.0g | 2.0g | 2.0g |
氢气的体积 | 334.5mL | 336.0mL | 337.5mL |
(4)根据表中数据,计算所得固体中无水AlCl3的质量分数 .
(5)有同学认为测得的无水AlCl3的质量分数偏低,你认为可能的原因有:(填序号)
①制备的氯气不足,②固体和气体无法充分接触,③无水AlCl3发生升华,造成损失.
【题目】下列物质分类的正确组合是
类别 组合 | 酸性氧化物 | 碱性氧化物 | 酸 | 碱 | 盐 |
A | CO2 | A12O3 | H2SO4 | KOH | NaHCO3 |
B | CO | Na2O | HC1 | NaOH | NaCl |
C | SO2 | Na2O2 | CH3COOH | Na2CO3 | CaF2 |
D | SO3 | CaO | HNO3 | Ca(OH)2 | CaCO3 |
A. A B. B C. C D. D