题目内容
【题目】下列离子方程式的书写正确的是
A. 漂白粉溶液中通入SO2气体:Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO
B. 碳酸氢钙溶液中加入过量的氢氧化钠溶液:HCO![]() +OH-===CO
+OH-===CO![]() +H2O
+H2O
C. 向Fe2(SO4)3溶液中加入过量铁粉:2Fe3++Fe===3Fe2+
D. 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+===H2SiO3↓+2Na+
【答案】C
【解析】A. 漂白粉溶液中通入SO2气体发生氧化还原反应生成硫酸根离子和氯离子,A错误;B. 碳酸氢钙溶液中加入过量的氢氧化钠溶液生成碳酸钙、碳酸钠和水,B错误;C. 向Fe2(SO4)3溶液中加入过量铁粉生成硫酸亚铁:2Fe3++Fe===3Fe2+,C正确;D. 向Na2SiO3溶液中滴加稀盐酸生成硅酸沉淀:SiO32-+2H+===H2SiO3↓,D错误,答案选C。

 名校课堂系列答案
名校课堂系列答案【题目】某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
(1)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)2NH3(g)+CO2(g).实验测得不同温度下的平衡数据列于下表:
温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
平衡气体总浓度(×10﹣3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
①可以判断该分解反应已经达到化学平衡的是(填字母).
A.2v(NH3)=v(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,计算25.0℃时的分解平衡常数为 .
(2)已知:NH2COONH4+2H2ONH4HCO3+NH3H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO﹣)随时间变化趋势如图所示.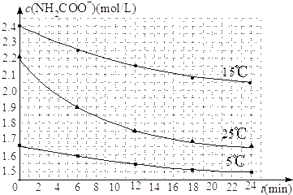
③计算25℃时,0~6min氨基甲酸铵水解反应的平均速率为 .
④根据图中信息,如何说明水解反应的平均速率随温度升高而增大: .