题目内容
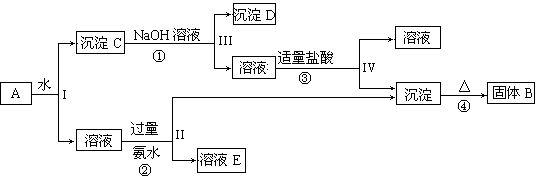
某混合物A中含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下列所示的物质之间的转变(已知:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3):

据此判断:
(1)固体B所含物质的化学式为________.
(2)固体E所含物质的化学式为________.
(3)反应①的离子方程式为________.
答案:
解析:
解析:
|
答案:(1)Al2O3.(2)(NH4)2SO4、K2SO4.(3)AlO 解析:铝及其化合物的性质与一般活泼金属元素的性质有差异之处,如Al2O3可溶于NaOH溶液,Fe2O3不能;KAl(SO4)2是一种复盐,可溶于水,完全电离,加入氨水可生成Al(OH)3沉淀,Al(OH)3在强碱溶液中溶解,而在氨水中不溶解.本题可用离子反应方程式描述从A开始的一系列变化:Al3++3NH3·H2O=Al(OH)3↓+3 |

练习册系列答案
 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案
相关题目