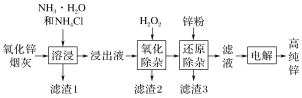
题目内容
【题目】以硫铁矿为原料制备氯化铁晶体(FeCl3·6H2O,270.5 g·mol-1)的工艺流程如图所示。

请回答下列问题:
(1)为加快焙烧反应的化学反应速率,可采取的措施为______、__________。(任写两条)
(2)焙烧后得到的Fe2O3在酸溶过程中发生反应的离子方程式为__________。
(3)过滤操作用到的玻璃仪器有烧杯、________、________。
(4)焙烧过程中产生的SO2可用过量的氨水进行吸收,所得溶液中溶质的名称为______、______。
(5)先向氯化铁溶液中加适量盐酸的目的是_________,再____、______、过滤、洗涤,最终得到氯化铁晶体。
【答案】粉碎硫铁矿 鼓入热的压缩空气 Fe2O3+6H+=2Fe3++3H2O 漏斗 玻璃棒 亚硫酸铵 一水合氨 抑制Fe3+的水解 (在HCl气氛中)蒸发浓缩 冷却结晶
【解析】
根据流程,黄铁矿在高温下煅烧可以得到铁的氧化物,将其溶于盐酸中,可以得到含有铁离子的盐溶液,氯化铁溶液蒸发浓缩、冷却结晶就可以得到氯化铁的晶体。
(1)为加快焙烧反应的化学反应速率,可采取的措施为粉碎硫铁矿、鼓入热的压缩空气。
(2)焙烧后得到的Fe2O3在酸溶过程中得到氯化铁溶液和水,发生反应的离子方程式为Fe2O3+6H+=2Fe3++3H2O。
(3)过滤操作用到的玻璃仪器有烧杯、漏斗、玻璃棒。
(4)焙烧过程中产生的SO2可用过量的氨水进行吸收生成亚硫酸铵和水,所得溶液中溶质的名称为亚硫酸铵、过量的氨水,溶质为一水合氨。
(5)铁离子易水解,先向氯化铁溶液中加适量盐酸的目的是抑制Fe3+的水解,再(在HCl气氛中)蒸发浓缩、冷却结晶、过滤、洗涤,最终得到氯化铁晶体。

【题目】电镀行业产生的酸性含铬废水对环境有污染,其中所含的Cr(VI)是主要污染物,可采用多种方法处理将其除去,查阅资料可知: 常温下,部分阳离子以氢氧化物形式沉淀时溶液的 pH 如下表:
阳离子 | Fe3+ | Fe2+ | Cr3+ |
开始沉淀的 pH | 1.9 | 7.0 | 4.3 |
沉淀完全的 pH | 3.2 | 9.0 | 5.6 |
I.腐蚀电池法
(1)向酸性含铬废水中投放废铁屑和焦炭,利用原电池原理还原 Cr(VI)。下列关于铁屑的说法中正确的是______________(填字母序号)。
a.作原电池的正极 b.在反应中作还原剂 c.铁屑生成 Fe3+可以进一步还原![]()
II.电解还原法
向酸性含铬废水中加入适量NaCl固体,以Fe为电极电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成排出,从而使废水中铬含量低于排放标准。装置如下图所示。

(2)B极连接电源的___________极;
(3)电解开始时,B 极上主要发生的电极反应为2H++2e-= H2↑,此外还有少量![]() 在B极上直接放电,该反应的电极反应式为 _______________。
在B极上直接放电,该反应的电极反应式为 _______________。
(4)①酸性环境可以促使![]() 到
到![]() 的转化,写出对应的离子方程式:__________________;
的转化,写出对应的离子方程式:__________________;
②写出酸性环境中 Fe2+还原![]() 的离子方程式_______________________。
的离子方程式_______________________。