题目内容
(1)理论上需要消耗MnO2多少克?
(2)被氧化的HCl的物质的量是多少?
(3)转移的电子数是多少?
| V |
| Vm |
(2)根据氯原子守恒及化合价变化可知,氯气中氯原子的物质的量即为被氧化的HCl的物质的量;
(3)反应中氯元素化合价由-1价升高为0价,据此根据生成的氯气计算注意电子的物质的量,根据N=nNA计算电子转移数目.
| 5.6L |
| 22.4L/mol |
由MnO2+4HCl(浓)
| ||
1 1
0.25mol 0.25mol
n(MnO2)=n(Cl2)=0.25mol,则m(MnO2)=0.25mol×87g.mol-1=21.75g,
答:需要消耗MnO221.75g;
(2)因Cl元素的化合价升高时被氧化,氧化产物为氯气,
则被氧化的HCl的物质的量n(HCl)=2n(Cl2)=2×0.25mol=0.5mol,
答:被氧化的HCl的物质的量是0.5mol;
(3)反应中氯元素化合价由-1价升高为0价,生成氯气0.25mol,故转移电子物质的量为0.25mol×2=0.5mol,故转移电子的数目为0.5mol×NAmol-1=0.5NA,
答:转移的电子数是0.5NA.

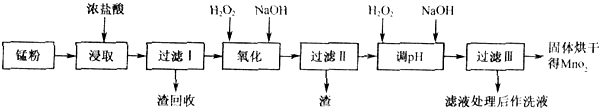
根据如图所示步骤并参考表格数据,回答下列问题.
生成氢氧化物沉淀的pH
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)2 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
(2)锰粉经浓盐酸浸取,过滤I除去不溶杂质后,向滤液中加入足量H2O2溶液,其作用是
(3)过滤Ⅰ所得滤液经氧化后,需加入NaOH溶液调节pH约为5.1,其目的是
(4)过滤Ⅱ所得滤液加入足量H2O2溶液并加入NaOH溶液调节pH约为9,使Mn2+氧化得到MnO2,反应的离子方程式为
(5)实验室进行过滤操作时.需要用到的玻璃仪器有
(16分)回收的废旧锌锰干电池经过处理后可得到锰粉(主要含MnO2、Mn(OH)2、Fe、NH4Cl和炭黑等),由锰粉制取MnO2的步骤和数据如下:
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)2 | 8.3 | 9.8 |
(1)在加热条件下,用浓盐酸浸取锰粉得到含有Mn2+、Fe3+等离子的溶液,MnO2与浓盐酸反应的离子方程式 ,该处理方法的缺点 。
(2)步骤I中滤渣的化学式 ,步骤I中滤渣的化学式 。
(3)向步骤I的滤液中加足量H2O2的作用为 。再加NaOH溶液调节pH在3.7<pH<8.3,目的是 。
(4)向步骤II的滤液中H2O2溶液,再加NaOH溶液调节pH为9,使Mn2+转化成MnO2,在这一过程中H2O2起 (填氧化剂、还原剂)的作用。
(16分)回收的废旧锌锰干电池经过处理后可得到锰粉(主要含MnO2、Mn(OH)2、Fe、NH4Cl和炭黑等),由锰粉制取MnO2的步骤和数据如下:
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)2 | 8.3 | 9.8 |
(2)步骤I中滤渣的化学式 ,步骤I中滤渣的化学式 。
(3)向步骤I的滤液中加足量H2O2的作用为 。再加NaOH溶液调节pH在3.7<pH<8.3,目的是 。
(4)向步骤II的滤液中H2O2溶液,再加NaOH溶液调节pH为9,使Mn2+转化成MnO2,在这一过程中H2O2起 (填氧化剂、还原剂)的作用。
(16分)回收的废旧锌锰干电池经过处理后可得到锰粉(主要含MnO2、Mn(OH)2、Fe、NH4Cl和炭黑等),由锰粉制取MnO2的步骤和数据如下:

|
物质 |
开始沉淀 |
沉淀完全 |
|
Fe(OH)3 |
2.7 |
3.7 |
|
Fe(OH)2 |
7.6 |
9.6 |
|
Fe(OH)2 |
8.3 |
9.8 |
(1)在加热条件下,用浓盐酸浸取锰粉得到含有Mn2+、Fe3+等离子的溶液,MnO2与浓盐酸反应的离子方程式 ,该处理方法的缺点 。
(2)步骤I中滤渣的化学式 ,步骤I中滤渣的化学式 。
(3)向步骤I的滤液中加足量H2O2的作用为 。再加NaOH溶液调节pH在3.7<pH<8.3,目的是 。
(4)向步骤II的滤液中H2O2溶液,再加NaOH溶液调节pH为9,使Mn2+转化成MnO2,在这一过程中H2O2起 (填氧化剂、还原剂)的作用。
回收的废旧锌锰干电池经过处理后可得到锰粉(主要含MnO2、Mn(OH)2、Fe、NH4Cl和炭黑等),由锰粉制取MnO2的步骤和数据如下:

| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)2 | 8.3 | 9.8 |
(1)在加热条件下,用浓盐酸浸取锰粉得到含有Mn2+、Fe3+等离子的溶液,MnO2与浓盐酸反应的离子方程式 ,该处理方法的缺点 。
(2)步骤I中滤渣的化学式 ,步骤I中滤渣的化学式 。
(3)向步骤I的滤液中加足量H2O2的作用为 。再加NaOH溶液调节pH在3.7<pH<8.3,目的是 。
(4)向步骤II的滤液中H2O2溶液,再加NaOH溶液调节pH为9,使Mn2+转化成MnO2,在这一过程中H2O2起 (填氧化剂、还原剂)的作用。