题目内容
12.环己烯常用于合成环醚、聚酯、橡胶.下列流程以环己烯为原料合成两种高分子化合物(H与合成橡胶).其中F可以做内燃机的抗冻剂,J分子中无饱和碳原子.R1-CH=CH-R2 $\stackrel{O_{3}、Zn/H_{2}O}{→}$R1-CHO+R2-CHO
已知:
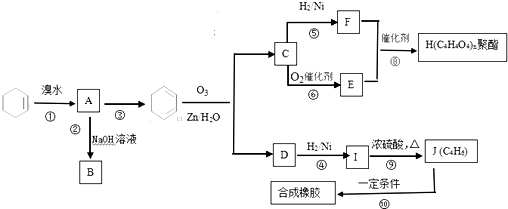
请回答下列问题:
(1)C中含有的官能团的名称是醛基.
(2)步骤③的反应条件除了加热还需要加入NaOH醇溶液.
(3)写出下列反应类型:⑥氧化反应.⑨消去反应.
(4)有机物B和I的关系为C.(填序号)
A.同系物 B.同分异构体 C.都属于醇类 D.都属于烃
(5)写出⑩反应的化学方程式:
 .
.(6)写出C与银氨溶液反应的化学方程式OHC-CHO+4[Ag(NH3)2]OH $→_{△}^{水浴}$H4NOOCCOONH4+4Ag↓+6NH3+2H2O.(注明条件)
分析 环己烯( )与溴发生加成反应生成A为
)与溴发生加成反应生成A为 ,A在氢氧化钠水溶液、加热条件下发生水解反应生成B为
,A在氢氧化钠水溶液、加热条件下发生水解反应生成B为 ,A发生消去反应生成
,A发生消去反应生成 ,
, 发生信息中反应生成OHCCH2CH2CHO、OHC-CHO,C与氢气发生加成反应生成F为二元醇、C发生氧化反应生成E为二元羧酸,故F、E含有相同碳原子数目,由F生成聚酯H的分子式可知,C中含有2个C原子,则D为OHCCH2CH2CHO,C为OHC-CHO,则F为HOCH2CH2OH、E为HOOC-COOH,F与E通过酯化反应进行的缩聚反应生成聚酯H为
发生信息中反应生成OHCCH2CH2CHO、OHC-CHO,C与氢气发生加成反应生成F为二元醇、C发生氧化反应生成E为二元羧酸,故F、E含有相同碳原子数目,由F生成聚酯H的分子式可知,C中含有2个C原子,则D为OHCCH2CH2CHO,C为OHC-CHO,则F为HOCH2CH2OH、E为HOOC-COOH,F与E通过酯化反应进行的缩聚反应生成聚酯H为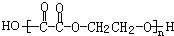 .D与氢气发生加成反应生成I为HOCH2CH2CH2CH2OH,由J的分子式可知I在浓硫酸、加热条件下发生消去反应,可推知J为CH2=CHCH=CH2,J发生加聚反应得到合成橡胶
.D与氢气发生加成反应生成I为HOCH2CH2CH2CH2OH,由J的分子式可知I在浓硫酸、加热条件下发生消去反应,可推知J为CH2=CHCH=CH2,J发生加聚反应得到合成橡胶 ,据此解答.
,据此解答.
解答 解:环己烯( )与溴发生加成反应生成A为
)与溴发生加成反应生成A为 ,A在氢氧化钠水溶液、加热条件下发生水解反应生成B为
,A在氢氧化钠水溶液、加热条件下发生水解反应生成B为 ,A发生消去反应生成
,A发生消去反应生成 ,
, 发生信息中反应生成OHCCH2CH2CHO、OHC-CHO,C与氢气发生加成反应生成F为二元醇、C发生氧化反应生成E为二元羧酸,故F、E含有相同碳原子数目,由F生成聚酯H的分子式可知,C中含有2个C原子,则D为OHCCH2CH2CHO,C为OHC-CHO,则F为HOCH2CH2OH、E为HOOC-COOH,F与E通过酯化反应进行的缩聚反应生成聚酯H为
发生信息中反应生成OHCCH2CH2CHO、OHC-CHO,C与氢气发生加成反应生成F为二元醇、C发生氧化反应生成E为二元羧酸,故F、E含有相同碳原子数目,由F生成聚酯H的分子式可知,C中含有2个C原子,则D为OHCCH2CH2CHO,C为OHC-CHO,则F为HOCH2CH2OH、E为HOOC-COOH,F与E通过酯化反应进行的缩聚反应生成聚酯H为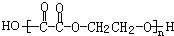 .D与氢气发生加成反应生成I为HOCH2CH2CH2CH2OH,由J的分子式可知I在浓硫酸、加热条件下发生消去反应,可推知J为CH2=CHCH=CH2,J发生加聚反应得到合成橡胶
.D与氢气发生加成反应生成I为HOCH2CH2CH2CH2OH,由J的分子式可知I在浓硫酸、加热条件下发生消去反应,可推知J为CH2=CHCH=CH2,J发生加聚反应得到合成橡胶 .
.
(1)C为OHC-CHO,C中含有的官能团的名称是:醛基,故答案为:醛基;
(2)步骤③是卤代烃发生的消去反应,反应条件是:NaOH醇溶液、加热,故答案为:NaOH醇溶液;
(3)反应⑥是OHCCH2CH2CHO转化得到HOOCCH2CH2COOH,属于氧化反应,反应⑨是HOCH2CH2CH2CH2OH发生消去反应生成CH2=CHCH=CH2,故答案为:氧化反应;消去反应;
(4)B为 ,I为HOCH2CH2CH2CH2OH,二者均含有羟基,不属于烃,均属于醇,B含有环酯,C为链状,结构不相似,组成通式不同,不是同系物,二者分子式不同,不是同分异构体,
,I为HOCH2CH2CH2CH2OH,二者均含有羟基,不属于烃,均属于醇,B含有环酯,C为链状,结构不相似,组成通式不同,不是同系物,二者分子式不同,不是同分异构体,
故答案为:C;
(5)反应⑩是CH2=CHCH=CH2发生加聚反应得到 ,反应方程式为:
,反应方程式为: ,
,
故答案为: ;
;
(6)C与足量银氨溶液反应的化学方程式:OHC-CHO+4[Ag(NH3)2]OH $→_{△}^{水浴}$H4NOOCCOONH4+4Ag↓+6NH3+2H2O,
故答案为:OHC-CHO+4[Ag(NH3)2]OH $→_{△}^{水浴}$H4NOOCCOONH4+4Ag↓+6NH3+2H2O.
点评 本题考查有机物的推断,需要学生对给予的信息进行利用,能较好的考查学生的自学能力,充分利用反应条件、有机物分子式与结构简式,采取正推法与逆推法相结合进行推断,需要熟练掌握官能团的性质,难度中等.

| A. | NO | B. | SO2 | C. | CO2 | D. | NO2 |
(Ⅰ)工业生产中已知3H2(g)+CO2(g)?CH3OH(g)+H2O (g)△H=-49.5KJ/mol
H2(g)+CO2(g)?CO(g)+H2O (g)△H=+41.3KJ/mol
(1)写出由H2 和CO 制 CH3OH 的热化学方程式CO(g)+2H2(g)=CH3OH(g)△H=-90.8KJ/mol
(2)H2 和CO 能自发反应生成CH3OH的条件是低温
(3)某温度下(1)中的平衡常数为1.2,能使平衡常数变为2的下列条件有D
A.增大压强 B.增大CO的浓度 C.升高温度 D.降低温度 E.使用催化剂
(4)在一定温度下密闭容器中,按H2与CO2体积比3:1进行投料,3H2+CO2?CH3OH+H2O 反应达到平衡的标志有BC
A.平衡常数不变 B.CO2的转化率不变
C.混和气体的平均相对分子质量不再改变 D.混合气体的密度不变
(Ⅱ) 将不同物质的量的H2O(g)和 CO分别通入体积为2L的恒容密闭容器中,发生反应:H2O(g)+CO(g)fCO2(g)+H2(g)△H,得到如下数据:
| 实验 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO | H2 | |||
| I | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| II | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| III | 900 | 2 | 1 | a | b | t |
(2)达平衡时实验Ⅱ和实验Ⅲ中H2O(g)的转化率的大小关系为:a2(HO)>a3(H2O)(填“>”、“<”或“=”).
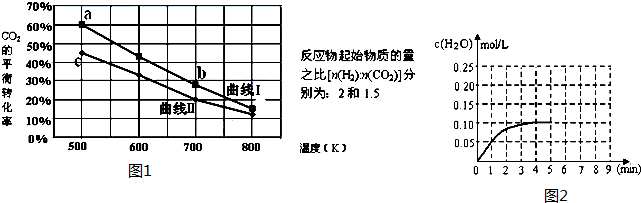
(Ⅲ) 一定条件下反应:6H2(g)+2CO2(g)?C2H5OH (g)+3H2O(g)△H它的有关数据如图1所示.
(1)下列说法正确的是C
A.曲线Ⅰ对应的反应物起始物质的量为1.5 B.达平衡时,v(H2)正=v(CO2)逆
C.a点对应的H2的平衡转化率为90% D.b点对应的平衡常数K值大于c点
(2)温度为T1时CO(g)+H2O(g)?H2(g)+CO2(g),在体积为2升的密闭 容器中加入0.4molCO2和0.4mol H2,第4分钟达到平衡,反应中H2O的浓度变化情况如图所示,在第5分钟时向体系中再充入0.2molCO2和0.2mol H2,(其它条件不变),第8分钟达平衡,请在图2中画出5到9分钟的H2O的浓度变化曲线.
| A. | 0.1mol-NH2(氨基)中含有的电子数为0.7NA | |
| B. | 60gSiO2中含有NA个SiO2分子 | |
| C. | 7.8g由Na2S和Na2O2组成的混合物中含有阴离子的数目为0.1NA | |
| D. | 1molFe与1mol氯气反应转移3NA个电子 |
| A. | 7.8gNa2O2和 Na2S混合物中所含阴离子的数目为0.1NA | |
| B. | 0.1mol丙烷中含有的共价键数目为0.8NA | |
| C. | 标准状况下,11.2LSO2中含有分子的数目为0.5NA | |
| D. | t℃,MgCO3的Kap=4×14-4,则饱和饱和溶液中含Mg2+数目为2×10-3NA |
| A. | FeCl3溶液可用于刻制印刷铜电路板 | |
| B. | Na2O2常用于潜水艇或呼吸面具的供氧剂 | |
| C. | 明矾溶于水形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| D. | 二氧化硅可做半导体材料 |
| A. | 将NaOH固体放入容量瓶中溶解 | |
| B. | 溶解NaOH后,待溶液冷却至室温后转移到容量瓶中 | |
| C. | 定容后,将容量瓶倒置摇匀,发现液面降低,继续加水至刻度线 | |
| D. | 定容时俯视液面,所得溶液浓度偏低 |
| A. | 在含有大量I-离子的溶液中:Cl?、Fe3+、Al3+、Cu2+ | |
| B. | 加入Al能放出H2的溶液中:Mg2+、NH4+、Cl-、Na+、SO42- | |
| C. | 使pH试纸变深蓝的溶液中:CO32-、NO3-、Na+、S2-、Al3+、SO32- | |
| D. | 在由水电离出的c(H+)=10-12 mol•L-1的溶液中:Na+、Ba2+、Cl?、Br? |
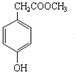 的分子式是C9H10O3,1mol化合物I完全燃烧,消耗10mol氧气.
的分子式是C9H10O3,1mol化合物I完全燃烧,消耗10mol氧气.