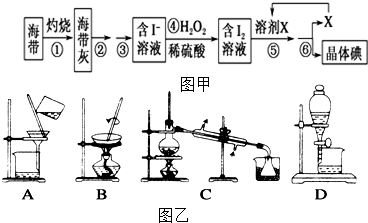
题目内容
9.1mol NH3含有的氢原子数与1.5mol H2含有的H原子数相同.分析 1个氨气分子中含3个H原子,1个氢气分子中含2个H原子,H原子的个数相同,则H原子的物质的量相同,以此计算.
解答 解:1.5mol H2含有的H原子为1.5mol×2=3mol,
氨气与氢气的H原子数相同,
则氨气的物质的量为$\frac{3mol}{3}$=1mol,
故答案为:1.
点评 本题考查物质的量的计算,为高频考点,把握物质的构成及物质的量与微粒个数的关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
20.在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.某课外小组模拟其原理选用适当的化学试剂和实验用品,用下图中的实验装置进行实验,证明潮湿的CO2可与过氧化钠反应生成O2.可供选择的药品有:石灰石、盐酸、饱和NaHCO3溶液、NaOH溶液、Na2O2固体
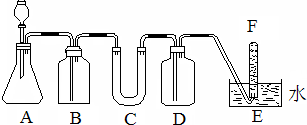
(1)如何检查该套装置的气密性?将E处导气管口放入水中,A处通过分液漏斗加水,如管口有气泡出现,说明气密性好.
(2)A是制取CO2的装置,写出A中发生反应的化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑.
(3)填写表中空格:
(4)写出过氧化钠与二氧化碳反应的化学方程式:2Na2O2+2CO2=2Na2CO3+O2.
(5)试管F中收集满气体后,要用拇指堵住试管口,移出水面,接下来的操作是立即把带火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气.

(1)如何检查该套装置的气密性?将E处导气管口放入水中,A处通过分液漏斗加水,如管口有气泡出现,说明气密性好.
(2)A是制取CO2的装置,写出A中发生反应的化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑.
(3)填写表中空格:
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 吸收挥发出来的HCl | |
| C | ||
| D |
(5)试管F中收集满气体后,要用拇指堵住试管口,移出水面,接下来的操作是立即把带火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气.
17.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 含有0.5NA个氮原子的氮气质量为14g | |
| B. | NA个氧分子与NA个氢分子的质量比是16:1 | |
| C. | 19.6g硫酸所含的硫原子数为0.1NA | |
| D. | 含有0.3NA个氧原子的O3质量为3.2g |
4.下列有关溶液配制的实验操作正确的是( )
| A. | 用浓盐酸配制稀盐酸时,一般用托盘天平称量所需的浓盐酸 | |
| B. | 将烧杯中的浓硫酸加水稀释,须等溶液冷却至室温后再转移到容量瓶中 | |
| C. | 量取浓盐酸的量筒需用蒸馏水洗净后,也需将洗涤液倒入烧杯中加水稀释 | |
| D. | 容量瓶不可长时间保存溶液 |
9.糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质.以下叙述不正确的是( )
| A. | 葡萄糖能发生氧化反应 | |
| B. | 淀粉水解的最终产物是葡萄糖 | |
| C. | 利用油脂在碱性条件下的水解,可以生产甘油和肥皂 | |
| D. | 蛋白质中只含C、H、O三种元素. |