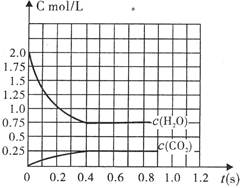
题目内容
在同温同压下,可逆反应:N2O4(g) 2NO2(g)达到平衡时气体体积是最初体积的1.5倍,则平衡时N2O4的体积分数是多少?
2NO2(g)达到平衡时气体体积是最初体积的1.5倍,则平衡时N2O4的体积分数是多少?
 2NO2(g)达到平衡时气体体积是最初体积的1.5倍,则平衡时N2O4的体积分数是多少?
2NO2(g)达到平衡时气体体积是最初体积的1.5倍,则平衡时N2O4的体积分数是多少? 平衡时N2O4的体积分数是33.33%
解法一:设原来N2O4为1体积,最后为1.5体积,气体增加了0.5体积,根据差量法知道生成NO2为1体积,消耗的N2O4为0.5体积,剩余的N2O4为0.5体积,所以平衡时N2O4的体积分数为:
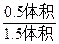 ×100%=33.33%
×100%=33.33%
解法二:设原来N2O4为a体积,则最后为1.5a体积,在反应中消耗了x体积的N2O4,则会生成2x体积的NO2,所以有:
a体积-x体积+2x体积=1.5a体积
x=0.5a
所以平衡时N2O4的体积分数为:
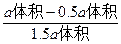 ×100%=33.33%。
×100%=33.33%。
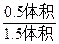 ×100%=33.33%
×100%=33.33%解法二:设原来N2O4为a体积,则最后为1.5a体积,在反应中消耗了x体积的N2O4,则会生成2x体积的NO2,所以有:
a体积-x体积+2x体积=1.5a体积
x=0.5a
所以平衡时N2O4的体积分数为:
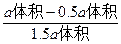 ×100%=33.33%。
×100%=33.33%。
练习册系列答案
相关题目
 2SO3(g),在这个过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率( )
2SO3(g),在这个过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率( )
 2HI(g)在密闭容器中达到平衡,缩小容器体积,增大压强,则下列说法正确的是( )
2HI(g)在密闭容器中达到平衡,缩小容器体积,增大压强,则下列说法正确的是( ) 2C,达到化学平衡状态,经测得平衡时:c(A2)="0.5" mol·L-1,c(B2)="0.1" mol·L-1,c(C)="1.6" mol·L-1,若A2,B2,C的起始浓度分别用a mol·L-1,b mol·L-1,c mol·L-1表示,要维持相同的平衡状态,请计算后完成下列问题:
2C,达到化学平衡状态,经测得平衡时:c(A2)="0.5" mol·L-1,c(B2)="0.1" mol·L-1,c(C)="1.6" mol·L-1,若A2,B2,C的起始浓度分别用a mol·L-1,b mol·L-1,c mol·L-1表示,要维持相同的平衡状态,请计算后完成下列问题: 2C+3D的化学反应速率和化学平衡随外界条件改变而变化的情况:
2C+3D的化学反应速率和化学平衡随外界条件改变而变化的情况:
 3Z(g)+2W(g),在某一时刻达到化学平衡时,测出的下列各生成物浓度的数据肯定错误的是( )
3Z(g)+2W(g),在某一时刻达到化学平衡时,测出的下列各生成物浓度的数据肯定错误的是( ) 2Q(g)+nR(g),达到平衡后,X的转化率为35%,混合气体的压强却比起始压强小,则方程中n的值是( )
2Q(g)+nR(g),达到平衡后,X的转化率为35%,混合气体的压强却比起始压强小,则方程中n的值是( )