题目内容
【题目】研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用子炼铁等。
①已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH1=akJ·mol-1
C(石墨)+CO2(g)=2CO(g) ΔH2=bkJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为______________。
(2)将CO2转化为甲醇的热化学方程式为: CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H
CH3OH(g)+H2O(g) △H
取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应。
①下列情况能说明反应已达平衡状态的是________(填字母)。
A.容器内气体密度不变 B.容器内气体总压强保持不变
C.绝热恒容时,平衡常数不变 D.v正(CH3OH)=3v逆(H2)
②反应过程中测得甲醇的体积分数α(CH3OH)与反应温度T的关系如图所示,则该反应的ΔH______0(填“>”、“<”或“=”)。
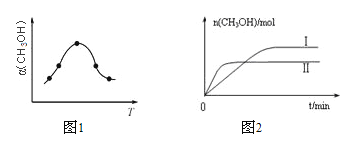
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ_____KⅡ(填“>”、“<”或“=”)。
(3)以CO2为原料还可以合成多种物质。
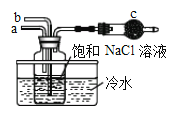
①如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。操作中先在_____处通入NH3气体,然后再在_______处通入CO2气体。
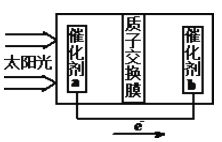
②人工光合作用能够借助太阳能用CO2和水制备化学原料,右图是通过人工光合作用制备HCOOH的原理示意图,请写出催化剂b处的电极反应式:________________。
【答案】(1) Fe2O3(s)+3CO( g)=2Fe(s) +3CO2(g) △H=(a-3b)kJ/mol
(2)①BC ②< ③ > (3)① a b ②CO2+2e-+2H+=HCOOH
【解析】(1)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=akJmol-1,②C(石墨)+CO2(g)=2CO(g)△H2=bkJmol-1,依据盖斯定律①-②×3得到Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=(a-3b)kJmol-1;
(2)①A.体积和质量始终不变,则密度始终不变,无法判断是平衡状态,故A错误;B.反应前后气体的物质的量不等,容器内气体总压强保持不变,说明气体总的物质的量一定,可判断是平衡状态,故B正确;C.平衡常数不变,说明温度不变,在绝热恒容时温度不变,是平衡状态,故C正确;D.当v正(CH3OH)=v逆(H2)时表明平衡状态,故D错误;答案为BC;②由图可知最高点反应到达平衡,达平衡后,温度越高,α(CH3OH)越小,平衡向逆反应进行,升高温度平衡吸热方向进行,逆反应为吸热反应,则正反应为放热反应,即△H<0;
③由图2可知,温度TⅠ<TⅡ,平衡时,温度越高CO的转化率越小,说明升高温度,平衡向逆反应移动,升高温度平衡向吸热反应移动,故该反应正反应为放热反应,则△H<0,升高温度,平衡向逆反应移动,所以KⅠ>KⅡ;
(3)①“侯氏制碱法”制取NaHCO3的原理是在饱和食盐水中通入氨气和二氧化碳,而得到NaHCO3的,在这一实验过程中,由于C02在水中的溶解度较小,而NH3的溶解度较大,为防止倒吸,b管通C02,a管通NH3,所以要在食盐水先a管通NH3然后再b管通C02;
②由图可知,左室投入是水,生成氧气与氢离子,催化剂a表面发生氧化反应,为负极,右室催化剂b表面通入二氧化碳,酸性条件下生成HCOOH,电极反应式为CO2+2H++2e-=HCOOH。







