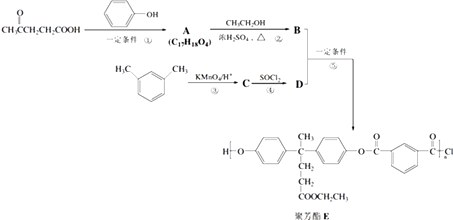
题目内容
【题目】下列关于电解质液的正确判断是( )
A.在pH=12的溶液中,K+、Cl﹣、HCO ![]() 、Na+可以大量共存
、Na+可以大量共存
B.在pH=0的溶液中,Na+、NO ![]() 、SO
、SO ![]() 、K+可以大量共存
、K+可以大量共存
C.由0.1 mol?L﹣1一元碱BOH溶液的pH=10,可推知BOH溶液中存在关系BOH→B++OH﹣
D.由0.1 mol?L﹣1一元酸HA溶液的pH=3,可推知NaA溶液中存在关系A﹣+H2O?HA+OH﹣
【答案】D
【解析】解:A.pH=12的溶液显碱性,HCO3﹣与OH﹣反应生成水和碳酸根离子,则不能共存,故A错误;B.pH=0的溶液显酸性,H+、NO ![]() 、SO
、SO ![]() 发生氧化还原反应,则不能共存,故B错误;
发生氧化还原反应,则不能共存,故B错误;
C.由0.1 molL﹣1一元碱BOH溶液的pH=10,则BOH为弱碱,存在电离平衡,则BOHB++OH﹣ , 故C错误;
D.由0.1 molL﹣1一元酸HA溶液的pH=3,HA为弱酸,则NaA溶液中存在水解离子反应为A﹣+H2OHA+OH﹣ , 故D正确;
故选:D.
【考点精析】本题主要考查了弱电解质在水溶液中的电离平衡的相关知识点,需要掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理才能正确解答此题.

 怎样学好牛津英语系列答案
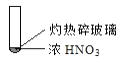
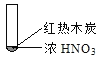
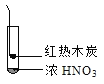
怎样学好牛津英语系列答案【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A. 由①中的红棕色气体,推断产生的气体一定是混合气体
B. 红棕色气体不能表明②中木炭与浓硝酸发生了反应
C. 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D. ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。玉溪一中化学兴趣小组在实验室中对NH3与NO2反应进行了探究。回答下列问题:
(1)氨气的制备
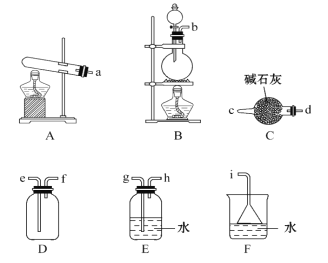
①氨气的发生装置可以选择上图中的________,反应的化学方程式为____________________。
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→_____________(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。
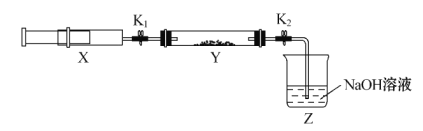
操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中____________ | ②反应的化学方程式______,该反应中被氧化和被还原的氮元素的质量比是____________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝聚 |
打开K2 | ③____________ | ④______________ |