题目内容
某化学实验小组通过系列实验探究钠及其化合物的性质,下列实验操作及现象与预期 实验目的或实验结论不一致的是
|
选项 实验操作及现象 实验目的或结论 A 用洁净铂丝蘸取溶液进行焰色反应,火焰呈黄色 原溶液中有Na+无K+ B 在0.1 mol/L的NaHCO3溶液中,加2滴酚酞显浅红色,微热,溶液颜色加深 验证盐类水解反应是吸热反应 C 用镊子从煤油中取出金属钠,切下绿豆大小的钠块,用滤纸吸干钠块表面的煤油,小心放入装有苯和水的试管中,钠块在苯与水界面上下浮动 比较钠、水和苯三种物质的密度大小 D 向饱和Na2CO3溶液中通入足量CO2,溶液变浑浊 NaHCO3的溶解度比Na2CO3的小 |
A
【解析】
试题分析:A、焰色反应呈黄色,只能证明存在Na+无法证明K+,错误;B、加热后溶液浅红焰色加深说明溶液碱性增强,则证明盐类水解是吸热的,正确;C、由钠在试管中的现象,可知结论正确;D、向饱和Na2CO3溶液中通CO2,发生反应:Na2CO3+CO2+H2O=2NaHCO3↓,正确。
考点:本题考查了焰色反应,盐类的水解,离子方程式的书写等知识。

 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
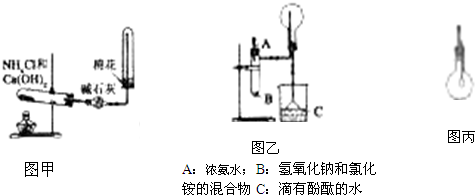
轻松课堂单元测试AB卷系列答案 如图1和2是某校实验探究小组制备NH3 并进行性质实验时的改进装置.按图1把仪器安装好,称取2g 固体氯化铵装入试管底部,再快速称取2g 氢氧化锅覆盖在氯化铵上方;立即用带有滴管的塞子塞紧(滴管预先吸入约2mL浓氨水);烧杯内盛滴有酚酞试液的水.把浓氨水滴入试管里,可立即观察到试管内发生剧烈反应,有大量气泡产生.将上述装置中收满NH3的圆底烧瓶取下,改装成图2所示的装置,胶头滴管内事先吸入2mLH2O,此时小气球系在玻璃管上呈自然松驰状态;将滴管内的水慢慢滴入烧瓶中,轻轻晃动烧瓶,通过观察实验现象便可以验证NH3的某个性质.按要求回答下列问题:
如图1和2是某校实验探究小组制备NH3 并进行性质实验时的改进装置.按图1把仪器安装好,称取2g 固体氯化铵装入试管底部,再快速称取2g 氢氧化锅覆盖在氯化铵上方;立即用带有滴管的塞子塞紧(滴管预先吸入约2mL浓氨水);烧杯内盛滴有酚酞试液的水.把浓氨水滴入试管里,可立即观察到试管内发生剧烈反应,有大量气泡产生.将上述装置中收满NH3的圆底烧瓶取下,改装成图2所示的装置,胶头滴管内事先吸入2mLH2O,此时小气球系在玻璃管上呈自然松驰状态;将滴管内的水慢慢滴入烧瓶中,轻轻晃动烧瓶,通过观察实验现象便可以验证NH3的某个性质.按要求回答下列问题: