题目内容
锌、稀硫酸和铜组成的原电池装置中,当导线中有1 mol电子通过时,理论上两极的变化是( )
①锌片溶解32.5g;②锌片增重32.5g;
③铜片上析出1g H2;④铜片上析出1mol H2
| A.①和③ | B.①和④ | C.②和③ | D.②和④ |
A
解析

食品保鲜所用的“双吸剂”,是由还原铁粉、生石灰、氯化钠、炭粉等按一定比例组成的混合物,可吸收氧气和水。下列分析不正确的是
| A.“双吸剂”中的生石灰有吸水作用 |
| B.“双吸剂”吸收氧气时,发生了原电池反应 |
| C.吸收氧气的过程中,铁作原电池的负极 |
| D.炭粉上发生的反应为:O2+4e-+4H+=2H2O |
在能源和环保的压力下,新能源电动汽车无疑将成为未来汽车的发展方向。如果电动汽车上使用新型钒电池,一次性充电3—5分钟后,续航能力可达1000公里;而成本造价只有目前锂电池的40%,体积和重量分别是锂电池的1/25和1/10。全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示:
下列有关该钒电池的说法不正确的是:
| A.该电池为可逆电池, 当左槽溶液逐渐由黄变蓝时,为充电过程,此时左槽溶液pH值升高 |
| B.放电过程中,右槽溶液中溶液颜色由紫色变为绿色 |
| C.充电过程中, H+可以通过质子交换膜向右移动,形成电流通路,并且参与电极反应 |
D.充电时若转移的电子数为3.01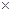 1023个,左槽溶液中n(H+)增加了0.5mol 1023个,左槽溶液中n(H+)增加了0.5mol |
①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池。①②相连时,外电路电流从②流向①:①③相连时,③为正极:②④相连时,②上有气泡逸出:③④相连时,③的质量减少,据此判断这四种金属活动性由大到小的顺序是 ( )
| A.①③②④ | B.①③④② | C.③④②① | D.③①②④ |
下图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法不正确的是( )。
| A.该电池的负极反应式为:CH3CH2OH+3H2O-12e-=2CO2↑+12H+ |
| B.该电池的正极反应式为:O2+4e-+4H+=2H2O |
| C.电流由O2所在的铂电极经外电路流向另一电极 |
| D.微处理器通过检测电流大小而计算出被测气体中酒精的含量 |
已知空气-锌电池的电极反应:
锌片:Zn-2OH--2e-=ZnO+H2O,
石墨:1/2O2+H2O+2e-=2OH-
据此推断锌片是( )
| A.负极,被氧化 | B.负极,被还原 |
| C.正极,被氧化 | D.正极,被还原 |
我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应为4Al+3O2+6H2O=4Al(OH)3,下列说法不正确的是( )
| A.正极反应式为O2+2H2O+4e-=4OH- |
| B.电池工作时,电流由铝电极沿导线流向铂电极 |
| C.以网状的铂为正极,可增大与氧气的接触面积 |
| D.该电池通常只需要换铝板就可以继续使用 |
用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定)。欲使溶液恢复到起始状态,可向溶液中加入( )
| A.0.1 mol CuO | B.0.1 mol CuCO3 |
| C.0.1 mol Cu(OH)2 | D.0.05 mol Cu2(OH)2CO3 |