题目内容
配制250ml 1.0 mol/L 的Na2CO3溶液,需称取Na2CO3固体多少克?取配制好的溶液25ml,往其中逐滴滴加1.0 mol/L的H2SO4溶液15ml,求生成的气体在标准状况下的体积是多少升?
26.5g, 0.005mol,0.112L
【解析】
试题分析:n(Na2CO3)=250ml*10-3L/ml*1.0mol/L=0.25mol; m(Na2CO3)=nM=0.25mol*106g/mol =26.5g;n(H+)=2n(H2SO4)=2*15ml*10-3L/ml*1.0mol/L=0.03mol
CO32- + H+ = HCO3-
1 1 1
0.025mol 0.025mol 0.025mol
HCO3- + H+ = H2O + CO2
1 1 1
0.30-0.025 n
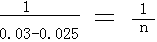 n = 0.005mol
n = 0.005mol
V(CO2)=n*Vm=0.005mol*22.4L/mol =0.112L
考点:本题考查物质的量浓度溶液配制的计算和碳酸钠和酸反应的与量有关的相关计算。

练习册系列答案
相关题目
