题目内容
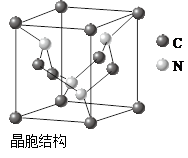
(10分)已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1~18列中的第7列元素。,D跟B可形成离子化合物其晶胞结构如图。
请回答:
(1)A元素的名称是________;
(2)B的元素符号是________,C的元素符号是________,B与A形成的化合物比C与A形成的化合物沸点高,其原因是________________;
(3)E属元素周期表中第________周期,第________族的元素,其元素名称是________,它的+2价离子的电子排布式为________________;
(4)从图中可以看出,D跟B形成的离子化合物的化学式为________;该离子化合物晶体的密度为a g·cm-3,则晶胞的体积是________(只要求列出算式)。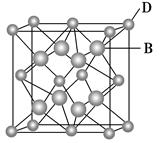
请回答:
(1)A元素的名称是________;
(2)B的元素符号是________,C的元素符号是________,B与A形成的化合物比C与A形成的化合物沸点高,其原因是________________;
(3)E属元素周期表中第________周期,第________族的元素,其元素名称是________,它的+2价离子的电子排布式为________________;
(4)从图中可以看出,D跟B形成的离子化合物的化学式为________;该离子化合物晶体的密度为a g·cm-3,则晶胞的体积是________(只要求列出算式)。

(1)氢
(2)F Cl 氟化氢分子间存在氢键,氯化氢分子间没有氢键
(3)四 ⅦB 锰 1s22s22p63s23p63d5 (4)CaF2 (cm3)
(cm3)
(2)F Cl 氟化氢分子间存在氢键,氯化氢分子间没有氢键
(3)四 ⅦB 锰 1s22s22p63s23p63d5 (4)CaF2
 (cm3)
(cm3)试题分析:A与其他4种元素既不在同一周期又不在同一主族,且A的原子序数最小,所以A为氢。B和C属同一主族,可以确定B是第二周期元素,C是第三周期元素。E是周期表中1~18列中的第7列元素,所以E是锰。D的原子序数比E小5,所以D是Ca。根据晶胞可以确定B和D形成的化合物的化学式为DB2,所以B是氟,C是氯。HF可以形成分子间氢键而HCl没有分子间氢键,所以HF的沸点高于HCl。该晶胞共有4个CaF2粒子,其质量=[78/(6.02×1023)]×4。又已知晶体的密度为a g·cm-3,则晶体的体积为
 (cm3)。
(cm3)。点评:晶胞计算是这两年高考物质结构选修题的热点,其中密度的计算,体积的计算,原子间距离的计算较难,需要数学立体几何做基础。

练习册系列答案
 优等生题库系列答案
优等生题库系列答案
相关题目
 (2)CO、N2的结构可表示为:
(2)CO、N2的结构可表示为: