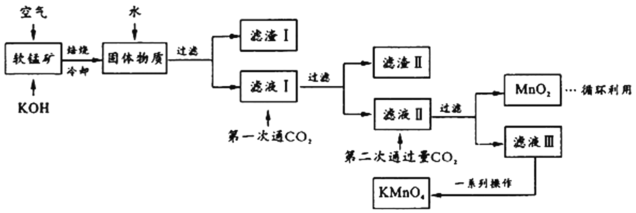
��Ŀ����
����Ŀ���ҹ������ƾõ���ʷ,����������ʪ����ͭ(Fe��CuSO4��Cu��FeSO4)���Իش��������}��
(1)Cu2+��δ�ɶԵ�������_____����H��O��S�縺���ɴ�С��˳��Ϊ______________________��
(2)��֪[Cu(NH3)4]SO4��һ������
��[Cu(NH3)4]SO4�л�ѧ��������______________��[Cu(NH3)4]2���Ľṹ��ʽΪ_________________������������ԭ���ӻ�����Ϊ____________________��
��NH3��H2O��HF�ķе��ɸߵ���Ϊ_________________��
(3)��ͭ�Ͻ�������Ϊ________________�����ĵ���(I3)�͵���(I4)�����ֱܷ�Ϊ2957 kJ/mol��5290 kJ/mol���Ƚ����ݲ�����ԭ��________________��
(4)��ͭ�Ͻ��һ�־���ṹΪ�������ͣ���ͼ��ʾ��
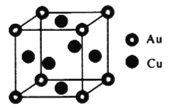
�ٸúϽ�Ļ�ѧʽΪ_______________��
����֪�úϽ���ܶ�Ϊd g/cm3�������ӏ�����ֵΪNA����þ������ⳤΪ__________nm��
���𰸡�1 O��S��H ���ۼ�����λ�������Ӽ� 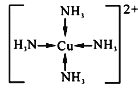 sp3�ӻ� H2O��HF��NH3 �������� ��̬��ԭ�ӵļ۵����Ų�ʽΪ3d64s2��ʧȥ3�����Ӻ������ӳʰ�����ȶ�״̬�����I4Զ����I3 AuCu3��Cu3Au
sp3�ӻ� H2O��HF��NH3 �������� ��̬��ԭ�ӵļ۵����Ų�ʽΪ3d64s2��ʧȥ3�����Ӻ������ӳʰ�����ȶ�״̬�����I4Զ����I3 AuCu3��Cu3Au 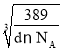 ��107
��107
��������
Cu��29��Ԫ�أ�Cuԭ��ʧȥ�����1��4s���Ӻʹ�����1��3d�����γ�Cu2+�����ݹ���ԭ���ɵ�Cu2+�ĺ�������Ų�ʽ��Ԫ�صķǽ�����Խǿ�縺��Խ��
(2)��[Cu(NH3)4]SO4��[Cu(NH3)4]2+��SO42-�γ����Ӽ���[Cu(NH3)4]2+��ͭ�����백����֮���γ���λ������������Nԭ����Hԭ��֮���γɹ��ۼ����ȼ���SO42-����ԭ��S�ŵ��Ӷ������ӻ������Ŀ��Ȼ�����ü۲���Ӷ���Ŀ�жϣ�
�ڷ���֮���γ������ʹ��е����ߣ�
(3)��ͭ�Ͻ������ڽ������壻Feԭ��ʧȥ3�������γ�3d5������ȶ��ṹ����ʧȥ1��������Ҫ�������϶ࣻ
(4)�پ�̯�����㾧����Au��Cuԭ����Ŀ��ȷ����ѧʽ��
�ڸ��ݾ����к��еĸ���Ԫ�ص�ԭ�Ӹ������㾧���������ٸ�����=![]() ���㣬��������
���㣬��������
(1)Cu2+�ĺ�������Ų�ʽΪ1s22s22p63s23p63d9��3d�������1��δ�ɶԵ��ӣ�������Ӿ��γ��˵��Ӷԣ����Cu2+����ֻ��1��δ�ɶԵ��ӣ�Ԫ�صķǽ�����Խǿ����縺��Խ������Ԫ�صķǽ����ԣ�O��S��H����Ԫ�صĵ縺���ɴ�С˳��Ϊ��O��S��H��
(2)��[Cu(NH3)4]SO4��[Cu(NH3)4]2+��SO42-�γ����Ӽ���[Cu(NH3)4]2+��ͭ�����백����֮���γ���λ������������Nԭ����Hԭ��֮���γɹ��ۼ�������[Cu(NH3)4]SO4�к��еĻ�ѧ������Ϊ���Ӽ������ۼ�����λ����[Cu(NH3)4]2+�Ľṹ��ʽΪ��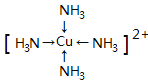 ��
��
SO42-����ԭ��S�ŵ��Ӷ���=![]() =0���ӻ������Ŀ=0+4=4������Sԭ�Ӳ�ȡsp3�ӻ���
=0���ӻ������Ŀ=0+4=4������Sԭ�Ӳ�ȡsp3�ӻ���
��NH3��H2O��HF����֮�䶼�������������IJ����������˷���֮�����������ʹ�����۷е����ߡ�����H2O����֮�������Ŀ�ࡢ���ǿ�����۷е���ߣ�HF����֮��������NH3���Ӽ�����ǿ����NH3��H2O��HF�ķе��ɸߵ���Ϊ��H2O��HF��NH3��
(3)��ͭ�Ͻ������ڽ������壻Fe��26��Ԫ�أ���̬��ԭ�ӵļ۵����Ų�ʽΪ3d64s2��Fe�ĵ�����������ʧȥ3d6��1��������Ҫ�������������ĵ�������ʧȥ3d5��1��������Ҫ������������3d5Ϊ������ȶ��ṹ����ʧȥ1��������Ҫ�������϶࣬�����ĵ���(I4)������Զ���ڵ���(I3)�����ܣ�
(4)�پ�����Auԭ����Ŀ=8��![]() =1��Cuԭ����Ŀ=6��
=1��Cuԭ����Ŀ=6��![]() =3���ʻ�ѧʽΪAuCu3��дΪCu3Au��
=3���ʻ�ѧʽΪAuCu3��дΪCu3Au��
�ھ�������m=![]() g�������ܶ�Ϊd g/cm3��������L=
g�������ܶ�Ϊd g/cm3��������L=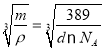 cm=
cm=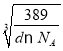 ��107 nm��
��107 nm��

 �ִʾ�ƪ��ͬ�����Ĵ��ϵ�д�
�ִʾ�ƪ��ͬ�����Ĵ��ϵ�д�����Ŀ��CO2��CH4���Ƶúϳ�����CH4(g)��CO2(g)2CO(g)��2H2(g) ��H=+247 kJ��mol��1����ʼ�¶Ⱦ�ΪT Kʱ����3�������а���ͬ��ʽͶ�뷴Ӧ�����������Ӧ�������Ϣ���±���
���� | ��ʼ���ʵ���/mol | CO2ƽ��ת����(��) | |||||
��� | �ݻ�/L | ���� | CH4(g) | CO2(g) | CO(g) | H2(g) | |
�� | 2 | ���º��� | 2 | 1 | 0 | 0 | 50% |
�� | 1 | 0.5 | 1 | 0 | 0 | ||
�� | 1 | ���Ⱥ��� | 1 | 0.5 | 0 | 0 | �� |
����˵����ȷ����
A.T Kʱ����ӦCH4(g)��CO2(g)2CO(g)��2H2(g)��ƽ�ⳣ��Ϊ1/3
B.�������з�Ӧ�ﵽƽ��ʱ����(CO2����)=50%
C.�������з�Ӧ�ﵽƽ��ʱ��Ӧ����123.5��247 kJ��mol��1��Χ��
D.�������з�Ӧ�ﵽƽ��ʱ����Ͷ��0.5 mol CH4��0.25 mol CO����Ӧ�ﵽ��ƽ��ǰ��v(��)<v(��)