题目内容
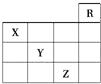
【题目】己知X、Y、Z、W为短周期主族元素,在周期表中的相对位置如下图所示,下列说法一定正确的是
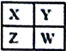
A. 若X元素在自然界中存在同素异形体,则W在同周期元素中,原子半径最小
B. 若HmXOn为强酸,则X 的氢化物溶于水一定显酸性(m、n均为正整数)
C. 若四种元素均为金属,则Z的最高价氧化物对应的水化物一定为强碱
D. 若四种元素均为非金属,则Y元素在化合物中不可能显示正化合价
【答案】C
【解析】若X为碳元素,W为磷元素,磷原子半径大于碳原子半径,A错误;n=1,HNO3 为强酸,NH3的水溶液显碱性,B错误;四种元素只能为 X为 Li、Y为 Be、Z 为Na、W 为Mg; 氢氧化钠溶液碱性最强,C正确;若X为碳、Y为氮,氮元素化合价有正价:+1、+2、+3、+4、+5等,D错误;正确选项C。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】室温下,下列有关两种溶液的说法不正确的是
序号 | ① | ② |
pH | 12 | 12 |
溶液 | 氨水 | 氢氧化钠溶液 |
A.①②两溶液中c(OH-)相等
B.①溶液的物质的量浓度为0.01mol·L-1
C.①②两溶液分别加水稀释10倍,稀释后溶液的pH:①>②
D.等体积的①②两溶液分别与0.01 mol·L-1的盐酸完全中和,消耗盐酸的体积:①>②
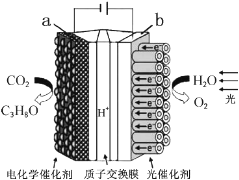
【题目】二氧化锆(ZrO2)是最重要的氧离子固体电解质,用于制造燃料电池、氧气含量测定仪等。可由锆英砂(主要成分为ZrSiO4,也可表示为ZrO2·SiO2;含有少量Fe2O3、Al2O3、SiO2杂质)通过如工艺流程法制得。
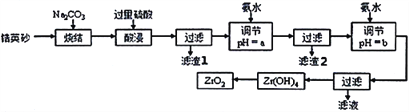
已知:①ZrO2具有两性,高温与纯碱共熔生成可溶于水的Na2ZrO3,与酸反应生成ZrO2+。
②部分金属离子在实验条件下开始沉淀和完全沉淀的pH如下表。
金属离子 | Fe3+ | Al3+ | ZrO2+ |
开始沉淀时pH | 1.9 | 3.3 | 6.2 |
沉淀完全时pH | 3.2 | 5.2 | 8.0 |
请回答下列问题:
(1)已知Zr元素的原子序数是40,请写出它在周期表中的位置:____________________________。
(2)烧结时ZrSiO4发生反应的化学方程式为__________________________;滤渣1的化学式为__________。
(3)调节pH=a时,a的范围应该是__________________;用氨水调节pH=b时,所发生反应的离子方程式为_______________________________________。
(4)本题的流程中,一共有三步过滤操作,北中最后一步过滤所得的Zr(OH)4沉淀需要洗涤,证明该沉淀已经洗涤干净的最佳操作方法是:______________________________________。
(5)工业上用铝热法冶炼锆,写出以ZrO2通过铝热法制取锆的化学方程式:________________。
(6)一种新型燃料电池用掺杂Y2O3的ZrO2晶体作电解质在熔融状态下传导O2-,一极通入空气,另一极通入乙烷,写出负极的电极反应式:________________________________。