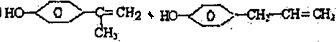题目内容
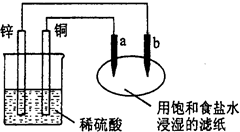 (2009?静安区一模)如图,a、b是两根碳棒.以下叙述正确的是( )
(2009?静安区一模)如图,a、b是两根碳棒.以下叙述正确的是( )分析:先判断装置名称,再根据原电池、电解池工作原理分析;
A、先判断电极名称,再根据得失电子判断反应类型;
B、先判断电极名称,再根据得失电子判断反应类型;
C、根据溶液中离子浓度的变化推断反应现象;
D、根据得失电子确定电极反应式;
A、先判断电极名称,再根据得失电子判断反应类型;
B、先判断电极名称,再根据得失电子判断反应类型;
C、根据溶液中离子浓度的变化推断反应现象;
D、根据得失电子确定电极反应式;
解答:解:铜-锌-稀硫酸装置能自发的进行氧化还原反应,且符合原电池的构成条件,所以该装置是原电池;右边装置有外接电源,所以构成了电解池.
A、a极接原电池的正极,所以a极是阳极,故A错误.
B、b极接原电池的负极,所以b极是阴极,故B错误.
C、随着反应的进行,a极上氯离子放电生成氯气,b极上氢离子放电生成氢气,所以b极附近氢氧根离子浓度增大,溶液呈碱性,滴加加酚酞试液,b极附近溶液颜色变红,故C正确.
D、铜片上氢离子得电子生成氢气,故D错误.
故选C.
A、a极接原电池的正极,所以a极是阳极,故A错误.
B、b极接原电池的负极,所以b极是阴极,故B错误.
C、随着反应的进行,a极上氯离子放电生成氯气,b极上氢离子放电生成氢气,所以b极附近氢氧根离子浓度增大,溶液呈碱性,滴加加酚酞试液,b极附近溶液颜色变红,故C正确.
D、铜片上氢离子得电子生成氢气,故D错误.
故选C.
点评:本题考查了原电池、电解池工作原理,要注意原电池、电解池的电极名称不同,原电池中的电极称作正、负极;电解池中的电极称作阴、阳极.

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目


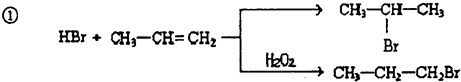
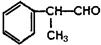 的物质,该物质是一种香料.
的物质,该物质是一种香料.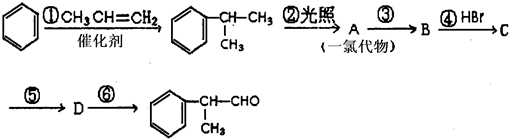
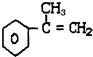 .
.
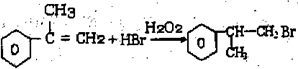
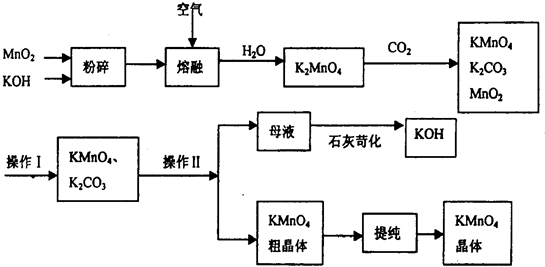
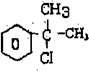 的水解产物
的水解产物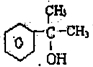 不能经氧化反应⑥得到产品
不能经氧化反应⑥得到产品