题目内容
4.A、B、C、D四种可溶性盐,它们的阳离子分别可能是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子分别可能是NO3-、SO42-、Cl-、CO32-中的某一种,且不重复出现.①若把四种盐分别溶于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色.
②若向①的四支试管中分别加盐酸,B盐溶液有沉淀产生,D盐溶液有无色无味气体逸出.
(1)根据①、②实验事实推断它们的化学式为:
A、BaCl2 B、AgNO3C、CuSO4 D、Na2CO3
(2)写出盐酸与B盐反应的离子方程式:Cl-+Ag+=AgCl↓;将A盐与D盐混合的现象有白色沉淀生成,及离子方程式Ba2++CO32-=BaCO3↓.
分析 给出八种离子形成四种可溶性盐,这个可以通过一一组合的形式确定可能存在的物质,之后结合进行实验和颜色限制进行继续排除,从而最终确定,如Ba2+不能和SO42-、CO32-结合,而只能和NO3-、Cl-;Ag+不能和SO42-、Cl-、CO32-三种离子结合,而只能和NO3-结合,则一定是BaCl2、AgNO3.Cu2+不能和CO32-结合,所以为CuSO4;Na+对应CO3 2-为Na2CO3.即四种物质为BaCl2、AgNO3、CuSO4、Na2CO3.
解答 解:由于是可溶性盐,所以溶液中存在的盐离子和阴离子对应物质一定是可溶性,根据盐类物质溶解性情况可知:Ba2+不能和SO42-、CO32-结合,而只能和NO3-、Cl-,Ag+不能和SO42-、Cl-、CO32-三种离子结合,而只能和NO3-结合,则一定是BaCl2、AgNO3.Cu2+不能和CO32-结合,所以为CuSO4,Na+对应CO3 2-为Na2CO3.即四种物质为BaCl2、AgNO3、CuSO4、Na2CO3;由于C盐是蓝色的,所以C为CuSO4;四支试管加入盐酸,B有沉淀,则B溶液为AgNO3;D生成无色气体,则为二氧化碳,即D为Na2CO3,所以A为BaCl2,
故答案为:BaCl2;AgNO3;CuSO4;Na2CO3;
(2)B溶液为AgNO3,盐酸与B盐反应的离子方程式Cl-+Ag+=AgCl↓;A为BaCl2,D为Na2CO3,将A盐与D盐混合发生反应:Ba2++CO32-=BaCO3↓,现象是有白色沉淀生成,故答案为:Cl-+Ag+=AgCl↓;有白色沉淀生成 Ba2++CO32-=BaCO3↓.
点评 多种离子的物质构成首先根据限制条件推断可能的物质存在,进一步通过实验来进行物质的对应关系的确认,注意离子的检验知识的应用是关键,难度不大.

 春雨教育同步作文系列答案
春雨教育同步作文系列答案 我国科学家最新研发的固体透氧膜提取金属钛工艺,其电解装置如图所示:将TiO2熔于NaCl-NaF融盐体系,以石墨为阴极,覆盖氧渗透膜的多孔金属陶瓷涂层为阳极,固体透氧膜把阳极和熔融电解质隔开,只有O2-可以通过.下列说法不正确的是( )
我国科学家最新研发的固体透氧膜提取金属钛工艺,其电解装置如图所示:将TiO2熔于NaCl-NaF融盐体系,以石墨为阴极,覆盖氧渗透膜的多孔金属陶瓷涂层为阳极,固体透氧膜把阳极和熔融电解质隔开,只有O2-可以通过.下列说法不正确的是( )| A. | a 极是电源的正极,O2-在熔融盐中从右往左迁移 | |
| B. | 阳极电极反应式为2O2--4e-=O2↑ | |
| C. | 阳极每产生4.48L的O2,理论上能生成0.2mol钛 | |
| D. | NaCl-NaF融盐的作用是降低熔化TiO2需要的温度 |
| 实验序号 | 实验步骤和操作 | 实验现象 |
| 实验一 | (I)取氧化亚铁固体[已部分变质,含有少量难溶于水的杂质Fe(OH)2Cl],向其中加入过量稀盐酸. (II)再加入稍过量的铁粉,振荡. | 固体完全溶解,溶液呈黄绿色 |
| 实验二 | (I)取实验一得到的溶液,加入KSCN溶液. (II)再加入少量H2O2溶液. | 无明显实验现象 溶液变红,有少量气泡 |
| 实验三 | (I)取10mL0.1mol/LKI溶液,滴加6滴0.1mol/L FeCl3溶液.(II)取少量上述黄色液体,滴加KSCN溶液. (III)另取上述黄色液体,加入淀粉溶液. | 溶液呈黄色 溶液变红 溶液变蓝 |
| 实验四 | (I)向实验三步骤I中所得的黄色溶液中加入2mLCCl4,充分振荡后,分离得到水层:重复操作三次. (II)向实验四步骤I中所得水层中加KSCN溶液. | 上层溶液无色 下层溶液为黄色 无明显实验现象 |
(1)实验一步骤(I)中Fe(OH)2Cl与盐酸反应的离子方程式是Fe(OH)2Cl+2H+=Fe3++Cl-+2H2O.
(2)实验一步骤(II)中的实验现象是溶液变为浅绿色,且有无色气体生成;加入稍过量铁粉的作用是防止亚铁离子被氧化为铁离子.
(3)实验二步骤(II)中溶液变红的原因是2H++2Fe2++H2O2=2Fe3++2H2O、Fe3++3SCN-=Fe(SCN)3(用离子方程式表示).
(4)实验二步骤(II)中生成气体的化学方程式是2H2O2$\frac{\underline{\;铁离子\;}}{\;}$2H2O+O2↑.
(5)实验三步骤(I)中的黄色液体中含有的溶质微粒除了K+、Cl-,还有Fe3+、I-、Fe2+、I2;该反应的离子方程式是2Fe3++2I-?2Fe2++I2.
(6)完成实验四步骤(I)时所用的主要玻璃仪器是分液漏斗、烧杯.
(7)已知用KSCN检验Fe3+时,Fe3+的最低显色浓度为1×10-3mol/L.实验四中最终溶液不变红的原因是碘被萃取至CCl4中,水层中的c(I2)下降,平衡2Fe3++2I-?2Fe2++I2正向移动,多次萃取后,Fe3+的浓度下降至1×10-3mol/L以下,无法显色.
| A. | SO2气体通入紫色石蕊试液中,溶液先变红后褪色 | |
| B. | FeCl3、Na2O2、Cu2S均可由相应单质直接化合生成 | |
| C. | 金属Mg与稀硫酸和CO2均能反应,其反应类型相同 | |
| D. | 氢氧化铝、碳酸铵、碳酸氢钠都既能与盐酸反应,又能与氢氧化钠溶液反应 |
| A. | 铁跟盐酸的反应 Fe+2H+═Fe3++H2↑ | |
| B. | 铁片和CuSO4溶液的反应 2Fe+3Cu2+═3Cu+2Fe3+ | |
| C. | 钠与跟水反应 Na+H2O═Na++OH-+H2↑ | |
| D. | 氯化铁溶液和氢氧化钠溶液的反应Fe3++3OH-═Fe(OH)3↓ |
| A. | 常温下可用铁制容器盛装浓硝酸 | B. | 氧化铁常用作红色油漆和涂料 | ||
| C. | 硅胶常用作食品、药品干燥剂 | D. | 生石灰可用作食品的抗氧化剂 |
| A. | a=4 | B. | 还原剂是Fe2+ | ||
| C. | 氧化剂是O2 | D. | Y的化学式为Fe3O4 |
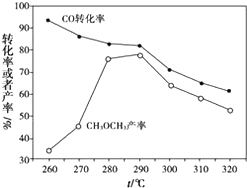 二甲醚(CH3OCH3)是无色气体,可作为一种新型能源.由合成气(组成为H2,CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下二个反应:
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源.由合成气(组成为H2,CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下二个反应: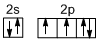 ;
;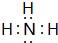 ,B的结构式为
,B的结构式为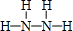 .
.