题目内容
在某100 mL的混合液中,硝酸和硫酸的物质的量浓度分别是0.4 mol/L、
0.1 mol/L,向该混合液中加入1.92 g铜粉,加热,待充分反应后,所得溶液中铜离子物质的量浓度是( )
| A.0.15 mol/L | B.0.225 mol/L |
| C.0.30 mol/L | D.0.45 mol/L |
B
解析

练习册系列答案
 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
现榨的苹果汁在空气中会由淡绿色变为棕黄色,其原因可能是( )
| A.苹果汁中含有Cu2+ | B.苹果汁中的Fe2+变成Fe3+ |
| C.苹果汁含有OH- | D.苹果汁含有Na+ |
下列变化需要加入适当的氧化剂才能完成的是 ( )
| A.CuO→Cu | B.HNO3→NO |
| C.Na2SO3→SO2 | D.FeCl2→FeCl3 |
氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Br2+SO2+2H2O=H2SO4+2HBr相比较,水的作用不相同的是
| A.2Na2O2+2H2O =4NaOH+O2↑ | B.Cl2 + H2O  HClO + HCl HClO + HCl |
| C.2F2+2H2O=4HF+O2 | D.4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
下列说法中,不正确的是
| A.利用铁加入硫酸铜溶液中的反应不可以比较Cu、Fe2+的还原性: |
| B.足量的铜跟一定量的浓硝酸反应只产生一种气体 |
| C.氮的固定不一定只有在高温、高压、催化剂的条件下才能实现 |
| D.用苯萃取溴水中的Br2时,有机层从分液漏斗的下端放出 |
铜既不溶于稀硫酸,也不溶于NaNO3溶液,但可溶于其混合溶液。已知某200 mL的1 mol/L硫酸溶液中含有0.6 mol/L NaNO3,理论上最多溶解Cu的质量是( )
| A.19.2 g | B.11.52 g | C.5.76 g | D.9.6 g |
用高铁酸钠(Na2FeO4)对河(湖)水消毒是城市饮水处理的新技术。已知反应Fe2O3+3Na2O2 2Na2FeO4+Na2O,下列说法正确的是( )
2Na2FeO4+Na2O,下列说法正确的是( )
| A.Na2O2既是氧化剂又是还原剂 |
| B.3 mol Na2O2发生反应,有12 mol电子转移 |
| C.在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌 |
| D.Na2FeO4既是氧化产物又是还原产物 |
水热法制备纳米颗粒Y(化合物)的反应为3Fe2++2S2O32-+O2+aOH-=Y+S4O62-+2H2O,下列说法中,不正确的是( )
| A.a=4 |
| B.Y的化学式为Fe2O3 |
| C.S2O32-是还原剂 |
| D.每有1 mol O2参加反应,转移的电子为4 mol |
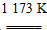 aTiCl4+cCO
aTiCl4+cCO Ti+2MgCl2
Ti+2MgCl2