题目内容
【题目】回答问题。
(1)用双线桥法标明电子转移的方向和数目。
①2Al+Fe2O3![]() 2Fe+Al2O3:________;
2Fe+Al2O3:________;
②MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O:________;
MnCl2+Cl2↑+2H2O:________;
(2)在②中氧化剂是________ ,还原剂是_________,被氧化的元素是_____,被还原的元素是______,氧化剂与还原剂之比是___________,当有71gCl2生成时,被氧化的HCl的物质的量是________mol。
【答案】 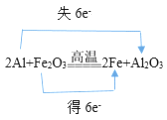
 MnO2 HCl Cl Mn 1:2 2
MnO2 HCl Cl Mn 1:2 2
【解析】试题分析:(1) ①2Al+Fe2O3![]() 2Fe+Al2O3的反应中,铝元素失去6个电子,铁元素得到6个电子;②MnO2+4HCl(浓)
2Fe+Al2O3的反应中,铝元素失去6个电子,铁元素得到6个电子;②MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O的反应中,氯元素失去2个电子,锰元素得到2个电子;(2)根据化合价变化,判断氧化剂、还原剂、被氧化的元素、被还原的元素;根据化合价变化可知,被氧化的氯化氢占参加反应氯化氢的一半。
MnCl2+Cl2↑+2H2O的反应中,氯元素失去2个电子,锰元素得到2个电子;(2)根据化合价变化,判断氧化剂、还原剂、被氧化的元素、被还原的元素;根据化合价变化可知,被氧化的氯化氢占参加反应氯化氢的一半。
解析:(1) ①2Al+Fe2O3![]() 2Fe+Al2O3的反应中,铝元素失去6个电子,铁元素得到6个电子,所以电子转移的方向和数目是
2Fe+Al2O3的反应中,铝元素失去6个电子,铁元素得到6个电子,所以电子转移的方向和数目是 ;
;
②MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O的反应中,氯元素失去2个电子,锰元素得到2个电子,所以电子转移的方向和数目是
MnCl2+Cl2↑+2H2O的反应中,氯元素失去2个电子,锰元素得到2个电子,所以电子转移的方向和数目是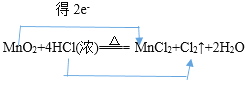 ;
;
(2)MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O的反应中,二氧化锰中锰元素化合价由+4降低为+2,氯化氢中氯元素化合价由-1升高为0,所以在②中氧化剂是MnO2 ,还原剂是HCl,被氧化的元素是Cl,被还原的元素是Mn;根据化合价变化可知,被氧化的氯化氢占参加反应氯化氢的一半,氧化剂与还原剂之比是1:2,当有71gCl2生成时,被氧化的HCl的物质的量是2mol。
MnCl2+Cl2↑+2H2O的反应中,二氧化锰中锰元素化合价由+4降低为+2,氯化氢中氯元素化合价由-1升高为0,所以在②中氧化剂是MnO2 ,还原剂是HCl,被氧化的元素是Cl,被还原的元素是Mn;根据化合价变化可知,被氧化的氯化氢占参加反应氯化氢的一半,氧化剂与还原剂之比是1:2,当有71gCl2生成时,被氧化的HCl的物质的量是2mol。


