题目内容
如图所示为实验室中常见的气体制备、干燥、收集和性质实验的部分仪器.试根据题目要求,回答下列问题:(设过程中所有发生的反应都恰好完全进行).
(1)若要制备纯净干燥的二氧化碳气体,仪器的连接顺序为
(2)生铁和钢都是铁的重要合金.某化学研究小组的同学要利用过氧化氢溶液和二氧化锰制备干燥、纯净的氧气并证明某生铁样品中含有碳元素并测定其含碳量,仪器连接顺序为:A→E→C→D1→B→D2.(已知D1、D2为2个澄清石灰水洗气瓶)
①装置A中所发生反应的化学方程式为
②其中装置E的作用是
③仪器D1中的现象是
④请写出装置B中所发生反应的化学方程式
⑤现取W g该生铁样品在纯氧中燃烧,当整套装置内的化学反应均完全进行后,经测量仪器D1增重m1 g,仪器B增重m2 g,仪器D2质量没有变化,则该试样中含碳元素的质量为
分析:(1)根据反应物的状态和反应条件确定实验室制取气体的发生装置,根据气体的密度和溶水性确定气体的收集装置,要得到干燥的二氧化碳,应在收集装置前面加一个干燥装置;熟记常用的化学方程式;
(2)①熟记常用的化学方程式;
②根据浓硫酸的性质进行分析;
③二氧化碳能使澄清的石灰水变浑浊;
④熟记常用的化学方程式;
⑤仪器D1和仪器B增加的是二氧化碳的质量,根据二氧化碳的质量可求出二氧化碳中碳元素的质量,根据质量守恒定律,化学反应前后元素的质量不变,二氧化碳中碳元素的质量等于生铁样品中碳元素的质量.
(2)①熟记常用的化学方程式;
②根据浓硫酸的性质进行分析;
③二氧化碳能使澄清的石灰水变浑浊;
④熟记常用的化学方程式;
⑤仪器D1和仪器B增加的是二氧化碳的质量,根据二氧化碳的质量可求出二氧化碳中碳元素的质量,根据质量守恒定律,化学反应前后元素的质量不变,二氧化碳中碳元素的质量等于生铁样品中碳元素的质量.
解答:解:(1)实验室通常用稀盐酸与大理石反应制取二氧化碳,反应物的状态是固态和液态,反应条件是常温,应选固-液不加热型的发生装置;二氧化碳的密度比空气大,能溶于水,只能用排水法收集;因为要收集到干燥的二氧化碳,所以应在收集装置前面加一个干燥装置,浓硫酸具有吸水性,可用来干燥二氧化碳,所以仪器的连接顺序为:A→E→F;碳酸钙和盐酸反应生成氯化钙、水和二氧化碳;CaCO3+2HCl=CaCl2+H2O+CO2↑,
故答案为:A→E→F;CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)①过氧化氢以二氧化锰为催化剂生成水和氧气,故答案为:2H2O2
2H2O+O2↑;
②浓硫酸具有吸水性,可以吸收氧气中的水蒸汽,故答案为:吸收氧气中的水蒸气(或干燥氧气);
③生铁中的碳和氧气反应生成二氧化碳,二氧化碳能使澄清的石灰水变浑浊,故答案为:澄清石灰水变浑浊;
④二氧化碳和氢氧化钠反应生成碳酸钠和水,故答案为:CO2+2NaOH=Na2CO3+H2O;
⑤碳元素的质量=(m1g+m2g)×
=
g,故答案为:
.
故答案为:A→E→F;CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)①过氧化氢以二氧化锰为催化剂生成水和氧气,故答案为:2H2O2
| ||
②浓硫酸具有吸水性,可以吸收氧气中的水蒸汽,故答案为:吸收氧气中的水蒸气(或干燥氧气);
③生铁中的碳和氧气反应生成二氧化碳,二氧化碳能使澄清的石灰水变浑浊,故答案为:澄清石灰水变浑浊;
④二氧化碳和氢氧化钠反应生成碳酸钠和水,故答案为:CO2+2NaOH=Na2CO3+H2O;
⑤碳元素的质量=(m1g+m2g)×
| 12 |
| 44 |
| 3(m1+m2) |
| 11 |
| 3(m1+m2) |
| 11 |
点评:本题考查常见气体制备原理及装置选择、探究物质的组成或测量物质的含量,为高频考点,侧重于基本理论的理解和应用的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目

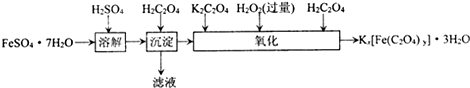
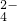 含量的实验步骤如下:
含量的实验步骤如下:
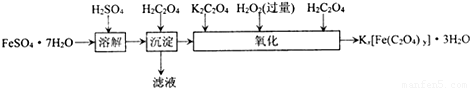
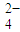 含量的实验步骤如下:
含量的实验步骤如下: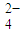 全部氧化成CO2,Fe2+全部氧化成Fe3+记录体积.
全部氧化成CO2,Fe2+全部氧化成Fe3+记录体积.