题目内容
实验活动课上,学生从废旧干电池中回收碳棒、锌皮、二氧化锰、氯化铵、氯化锌等主要物质.
(1)二氧化锰的作用是与正极上的产物(H2)反应,生成Mn2O3,写出该反应的化学方程式:______.
(2)得到氯化铵和氯化锌的晶体混合物后,检验其中含有NH4+的方法是______;
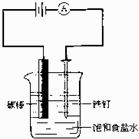
(3)学生将洗净的碳棒和锌皮堆放在一起晾干,一段时间后,发现锌皮上出现锈斑,用电极反应式阐明原因:______.
(1)二氧化锰的作用是与正极上的产物(H2)反应,生成Mn2O3,写出该反应的化学方程式:______.
(2)得到氯化铵和氯化锌的晶体混合物后,检验其中含有NH4+的方法是______;
(3)学生将洗净的碳棒和锌皮堆放在一起晾干,一段时间后,发现锌皮上出现锈斑,用电极反应式阐明原因:______.
(1)二氧化锰与H2反应,生成Mn2O3,根据电子注意守恒,氢气被氧化生成水,反应方程式为:2MnO2+H2=Mn2O3+H2O,
故答案为:2MnO2+H2=Mn2O3+H2O;
(2)检验其中含有NH4+的方法是;取少量晶体溶于NaOH溶液,加热,将湿润的红色石蕊试纸置于试管口,若试纸变蓝,则说明晶体中含有NH4+,
故答案为:取少量晶体溶于NaOH溶液,加热,将湿润的红色石蕊试纸置于试管口,若试纸变蓝,则说明晶体中含有NH4+;
(3)碳棒和锌皮与水膜构成原电池,锌为负极,反应氧化反应:Zn→Zn2++2e-,碳棒为正极,氧气放电生成氢氧根,电极反应式为:O2+2H2O+4e-→4OH-,Zn发生吸氧腐蚀,
故答案为:负极:Zn→Zn2++2e-,正极:O2+2H2O+4e-→4OH-.
故答案为:2MnO2+H2=Mn2O3+H2O;
(2)检验其中含有NH4+的方法是;取少量晶体溶于NaOH溶液,加热,将湿润的红色石蕊试纸置于试管口,若试纸变蓝,则说明晶体中含有NH4+,
故答案为:取少量晶体溶于NaOH溶液,加热,将湿润的红色石蕊试纸置于试管口,若试纸变蓝,则说明晶体中含有NH4+;
(3)碳棒和锌皮与水膜构成原电池,锌为负极,反应氧化反应:Zn→Zn2++2e-,碳棒为正极,氧气放电生成氢氧根,电极反应式为:O2+2H2O+4e-→4OH-,Zn发生吸氧腐蚀,
故答案为:负极:Zn→Zn2++2e-,正极:O2+2H2O+4e-→4OH-.

练习册系列答案
相关题目