题目内容
雾霾含有大量的污染物SO2、NO。工业上变“废”为宝,吸收工业尾气SO2和NO,可获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
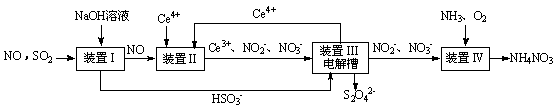
(1)装置Ⅰ中的主要离子方程式为 。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如图所示。

①若是0.1molNaOH反应后的溶液,测得溶液的pH=8时,溶液中个离子由大到小的顺序是 。
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: 。
(3)写出装置Ⅱ中,酸性条件下的离子方程式 。
(4)装置Ⅲ还可以使Ce4+再生,其原理如下图所示。
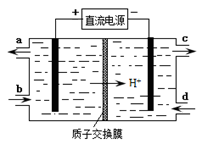
①生成Ce4+从电解槽的 (填字母序号)口流出。
②写出与阴极的反应式 。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示,计算结果保留整数)

(1)装置Ⅰ中的主要离子方程式为 。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如图所示。

①若是0.1molNaOH反应后的溶液,测得溶液的pH=8时,溶液中个离子由大到小的顺序是 。
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: 。
(3)写出装置Ⅱ中,酸性条件下的离子方程式 。
(4)装置Ⅲ还可以使Ce4+再生,其原理如下图所示。

①生成Ce4+从电解槽的 (填字母序号)口流出。
②写出与阴极的反应式 。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示,计算结果保留整数)
(每空2分)
(1)SO2 + OH-="==" HSO3-
(2)①c(Na+>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
②HSO3- 在溶液中存在电离平衡:HSO3- SO32-+H+,加入CaCl2溶液后,Ca2++SO32-="==" CaSO3↓使电离平衡右移,c(H+)增大。
SO32-+H+,加入CaCl2溶液后,Ca2++SO32-="==" CaSO3↓使电离平衡右移,c(H+)增大。
(3)NO+2H2O+3Ce4+===3Ce3++NO3-+4H+、NO+H2O+Ce4+===Ce3++NO2-+2H+
(4)①a ②2HSO3-+4H++ 4e-="==" S2O32-+3H2O
(5)243a(242a、244a、5600a /23都给分)
(1)SO2 + OH-="==" HSO3-
(2)①c(Na+>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
②HSO3- 在溶液中存在电离平衡:HSO3-
 SO32-+H+,加入CaCl2溶液后,Ca2++SO32-="==" CaSO3↓使电离平衡右移,c(H+)增大。
SO32-+H+,加入CaCl2溶液后,Ca2++SO32-="==" CaSO3↓使电离平衡右移,c(H+)增大。(3)NO+2H2O+3Ce4+===3Ce3++NO3-+4H+、NO+H2O+Ce4+===Ce3++NO2-+2H+
(4)①a ②2HSO3-+4H++ 4e-="==" S2O32-+3H2O
(5)243a(242a、244a、5600a /23都给分)
试题分析:(1)装置Ⅰ中的将SO2变成了HSO3-,离子方程式是SO2 + OH-="==" HSO3-。
(2)①若是0.1molNaOH反应后的溶液,测得溶液的pH=8时,图像中的c(SO32-)>c(HSO3-),而c(OH-)=10-6mol/L,远小于c(OH-),故溶液中离子浓度为:c(Na+>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)。②HSO3- 在溶液中存在电离平衡:HSO3-
 SO32-+H+,加入CaCl2溶液后,Ca2++SO32-="==" CaSO3↓使电离平衡右移,c(H+)增大。
SO32-+H+,加入CaCl2溶液后,Ca2++SO32-="==" CaSO3↓使电离平衡右移,c(H+)增大。(3)在酸性条件下装置Ⅱ中,Ce4+将NO氧化为NO3-或NO2-,本身还原为Ce3+,有两个反应,即NO+2H2O+3Ce4+===3Ce3++NO3-+4H+、NO+H2O+Ce4+===Ce3++NO2-+2H+。
(4)装置Ⅲ使Ce3+→Ce4+,反应过程失去电子,在阳极发生,接电源正极,故生成Ce4+从电解槽的a口出来;阴极HSO3-得到电子生成S2O32,即2HSO3-+4H++ 4e-="==" S2O32-+3H2O。
(5)装置Ⅳ中的与O2和NO2-参加的反应:2NH3+2H++O2+2NO2-===2NH4NO3,n(O2)=n(NO2-)= ×1000L×a g·L-1/46g·mol-1,V(O2)=22.4L·mol-1 n(O2)= 243a。

练习册系列答案
相关题目
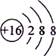
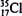
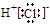
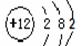
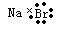
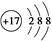
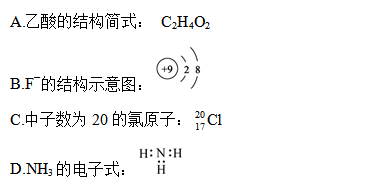
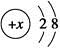 ,其与Cl-形成的强电解质都是离子化合物
,其与Cl-形成的强电解质都是离子化合物