题目内容
下表是NaCl和CsCl的熔沸点的比较。
| NaCl | CsCl |
熔点 | 801 ℃ | 645 ℃ |
沸点 | 1 413 ℃ | 1 290 ℃ |
(1)同为离子晶体,为什么NaCl的熔沸点比CsCl的高?请从影响离子键强弱的因素入手进行分析。
(2)实验证明,干燥的NaCl晶体不导电,熔融的NaCl或NaCl溶液却可以导电,你能说明其中的原因吗?
(1)离子键是存在于阴、阳离子之间的一种静电作用。其强弱与阴、阳离子的半径和离子电荷数有关。一般来说,离子半径越小,离子电荷数越高,离子键就越强,晶体熔沸点就越高。从库仑定律可直接看出这一关系(![]() )。对于NaCl和CsCl,由于阴、阳离子所带电荷数相同,而r(Na+)<r(Cs+),所以F(NaCl)>F(CsCl),故熔沸点为:NaCl>CsCl。
)。对于NaCl和CsCl,由于阴、阳离子所带电荷数相同,而r(Na+)<r(Cs+),所以F(NaCl)>F(CsCl),故熔沸点为:NaCl>CsCl。
(2)电流是由带电粒子的定向移动形成的。NaCl晶体中虽有带电的Na+、Cl-存在,但由于较强的离子键将阴、阳离子紧密结合而不能自由移动,故固态不能导电,而当晶体受热熔化时,由于温度升高,离子运动加快,克服了阴、阳离子间的作用力,产生了自由移动的离子,所以,熔融NaCl能导电。当NaCl晶体溶于水时,受水分子的影响,离子间作用力减弱,电离成能自由移动的水合离子,所以,NaCl水溶液也能导电。

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
(1)下列有关晶体的叙述中错误的是
A.石英晶体中的硅原子以sp2杂化方式与周围的氧原子形成共价键
B.氯化钠晶体中每个Na+或Cl-周围紧邻的有6个Cl-或Na+
C.在CsCl晶体中每个Cs+周围紧邻的有8个Cl-,而和每个Cl-等距离紧邻的也有8个Cs+
D.在面心立方密堆积的金属晶体中,每个金属原子周围紧邻的有4个金属原子
(2)已知MgO的晶体结构属于NaCl型.某同学画出的MgO晶胞结构示意图如图1所示,请改正图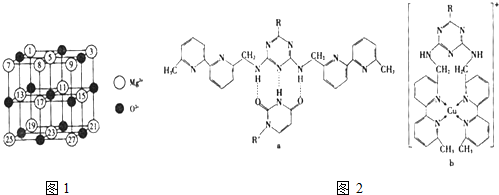
中错误: .(用文字表述)
(3)第三周期部分元素氟化物的熔点见下表:
解释表中氟化物熔点差异的原因: .
(4)人工模拟是当前研究的热点.有研究表明,化合物X可用于研究模拟酶,当其结合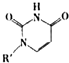 或Cu(I)(I表示化合价为+1)时,分别形成a和b:
或Cu(I)(I表示化合价为+1)时,分别形成a和b:
分析a和b中微粒间的相互作用(包括化学键和分子间相互作用)的差异,试指出
其不同点:a中含 ,b中含 .(用“氢键”、“配位键”、“极性键”、“非极性键”等填空)
A.石英晶体中的硅原子以sp2杂化方式与周围的氧原子形成共价键
B.氯化钠晶体中每个Na+或Cl-周围紧邻的有6个Cl-或Na+
C.在CsCl晶体中每个Cs+周围紧邻的有8个Cl-,而和每个Cl-等距离紧邻的也有8个Cs+
D.在面心立方密堆积的金属晶体中,每个金属原子周围紧邻的有4个金属原子
(2)已知MgO的晶体结构属于NaCl型.某同学画出的MgO晶胞结构示意图如图1所示,请改正图

中错误:
(3)第三周期部分元素氟化物的熔点见下表:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
(4)人工模拟是当前研究的热点.有研究表明,化合物X可用于研究模拟酶,当其结合
 或Cu(I)(I表示化合价为+1)时,分别形成a和b:
或Cu(I)(I表示化合价为+1)时,分别形成a和b:分析a和b中微粒间的相互作用(包括化学键和分子间相互作用)的差异,试指出
其不同点:a中含