题目内容
9.M、N、Q、R为原子序数依次增大的短周期主族元素,N是形成有机物基本骨架的元素,M与N、Q可分别形成共价化合物S、T,且S、T分子中含相同的电子数.金属单质R在Q的单质中燃烧生成的化合物W可与T发生氧化还原反应.下列说法正确的是( )| A. | 原子半径大小:M<N<Q<R | |
| B. | W中的阴阳离子个数比为1:1,属于离子化合物 | |
| C. | Q的某单质可作水的消毒剂,该单质在大气中含量越多,对人体越有益 | |
| D. | M和N、Q均能形成既含极性键又含非极性键的分子 |
分析 M、N、Q、R为原子序数依次增大的短周期主族元素,N是形成有机物基本骨架的元素,N为C;M与N、Q可分别形成共价化合物S、T,且S、T分子中含相同的电子数,M为H,Q为O或F,且金属单质R在Q的单质中燃烧生成的化合物W可与T发生氧化还原反应,则R为Na,Q为O,W为Na2O2,T为H2O,则S为CH4,以此来解答.
解答 解:由上述分析可知,M为H,N为C,Q为O,R为Na,
A.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径大小:M<Q<N<R,故A错误;
B.W为Na2O2,W中的阴阳离子个数比为1:2,含离子键,属于离子化合物,故B错误;
C.Q的某单质可作水的消毒剂,该单质为臭氧,在大气中含量过多,对人体有害,故C错误;
D.M和N形成的乙烷,M、Q形成的过氧化氢,均含极性键、非极性键,故D正确;
故选D.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素化合物知识、原子序数、10电子微粒来推断元素为解答关键,侧重分析与应用能力的考查,注意规律性知识及元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
2. 短周期元素Q、R、T、W在周期表中的位置如图所示,其中,T所处周期序数与主族序数相等,则下列说法正确的是( )
短周期元素Q、R、T、W在周期表中的位置如图所示,其中,T所处周期序数与主族序数相等,则下列说法正确的是( )
 短周期元素Q、R、T、W在周期表中的位置如图所示,其中,T所处周期序数与主族序数相等,则下列说法正确的是( )
短周期元素Q、R、T、W在周期表中的位置如图所示,其中,T所处周期序数与主族序数相等,则下列说法正确的是( )| A. | 元素R的最高价氧化物对应的水化物是高沸点酸 | |
| B. | 元素T和W各自形成的简单离子都能促进水的电离 | |
| C. | 简单离子半径:W>T>R | |
| D. | 常温下,T的单质能完全溶于R的最高价氧化物的水化物的浓溶液中 |
17.已知25℃时,CH3COOH、HCN和H2CO3的电离常数如表:
下列有关叙述错误的是( )
| CH3COOH | HCN | H2CO3 |
| K=1.75×10-5 | K=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
| A. | 向NaCN溶液中通入少量CO2的离子方程式:CN-+H2O+CO2═HCN+HCO3- | |
| B. | 25℃时,反应CH3COOH+CN-?HCN+CH3COO-的化学平衡常数为3.57×104 | |
| C. | 中和等体积、等物质的量浓度的CH3COOH和HCN溶液,消耗NaOH的量前者小于后者 | |
| D. | 等物质的量浓度的CH3COONa和NaCN混合溶液中:c(CH3COO-)>c(CN-)>c(OH-)>c(H+) |
14.下列所示装置正确且能完成相关实验的是( )
| A. |  所示装置制取并观察Fe(OH)2 | |
| B. | 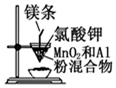 所示装置制取金属锰 | |
| C. |  所示装置配制100 mL 0.1 mol•L-1 硫酸溶液 | |
| D. |  所示装置比较N、C、Si的非金属性强弱 |
14.下列装置或操作不能达到实验目的是( )
| A. |  装置关闭止水夹,往长颈漏斗加水,根据水位的变化情况可检查该装置的气密性 | |
| B. | 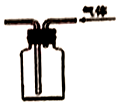 装置可用来收集NH3、H2等 | |
| C. |  装置可用来吸收极易溶于水的气体如NH3、HCl等 | |
| D. |  装置洗涤沉淀物时,向漏斗中加蒸馏水至浸没沉淀物,滤出溶液并重复操作2-3次 |
1.现有两个热化学方程式:下列说法中正确的是( )


| A. | 反应①②中都存在:△S>0 | B. | 反应②高温时,可自发进行 | ||
| C. | 在通常情况下,①②都能自发进行 | D. | 反应①一定不能自发进行 |
19.下列有关“化学与生活”的叙述不正确的是( )
| A. | 点燃爆竹后,硫燃烧生成SO3 | |
| B. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| C. | 硫酸亚铁补血剂应与维生素C同服,是因为维生素C能防止Fe2+氧化 | |
| D. | 使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力减弱 |
 能源问题是人类社会面临的重大课题.甲醇是未来重要的绿色能源之一.
能源问题是人类社会面临的重大课题.甲醇是未来重要的绿色能源之一.