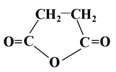
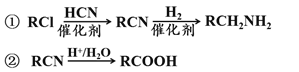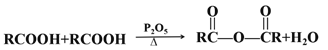题目内容
【题目】
人类社会的发展与进步与材料的发展密不可分,而金属是人类常用的一类材料如铜、铁合金等等。
(1)基态Cu原子的价电子排布式为__________,在元素周期表中的位置为___________。
(2)Cu2O为半导体材料,可由乙醛(CH3CHO)和新制氢氧化铜反应得到。乙醛中碳原子的杂化方式有______________,乙醛分子中![]() 键与
键与![]() 键的数目之比为____________。
键的数目之比为____________。
(3)制造单晶硅太阳能电池片时,一般掺杂微量的铜、碳、硼、氮等。铜、碳、硼、氮元素的电负性由大到小的顺序是_________________。(用元素符号表示)
(4)Cu(OH)2溶于氨水形成深蓝色的[Cu(NH3)4]2+,该配合物中NH3的价层电子对互斥模型为_____________。
(5)铁在不同温度范围有不同的晶体结构,在室温下为体心立方,当温度升高到912℃,则转变为面心立方。铁的体心立方堆积和面心立方最密堆积的配位数分别为____、_____。若铁原子半径为r pm,则铁为面心立方最密堆积时的晶体密度为___________g/cm3(阿伏伽德罗常数的值用NA 表示,1pm=10-12m,写出计算式即可)。
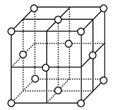
面心立方晶胞
【答案】 3d104s1 第四周期第IB族 sp3、sp2 6:1 N>C>B>Cu 四面体形 8 12 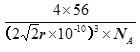
【解析】(1)Cu为29号,基态Cu原子价电子排布式为:3d104s1;在元素周期表中的位置为第四周期第IB族。
(2)乙醛中甲基上的C形成4条σ键,无孤电子对,因此采取sp3杂化,醛基中的C形成3条σ键和1条π键,无孤电子对,采取sp2杂化;1个乙醛分子含有6个σ键和一个π键,则σ键和π键数目之比为6:1。
(3)同周期元素的电负性随原子序数增大而增大,同主族元素的电负性随原子序数增大而减小,故电负性N>C>B,元素的电负性越大,表示其原子在化合物中吸引电子的能力越强,因此非金属元素B的电负性应大于金属元素Cu,故电负性N>C>B>Cu。
(4)[Cu(NH3)4]2+离子中,Cu2+给出空轨道,NH3提供孤对电子,Cu2+与NH3之间形成配位键,单独看NH3应该是三角锥形,在该配合物中看应该为四面体形。
(5)所谓配位数指任一原子周围最近邻且等距离的原子数;如图: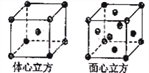 ,对于体心立方晶体,离中心原子最近的原子有8个;对于面心立方晶体,任取其中一个原子为原点作x、y、z三个平面,构成空间直角坐标系,那么,在每一个平面中,都有四个配位原子在其左上、左下、右上、右下。三个平面共12个,所以铁的体心立方堆积和面心立方最密堆积的配位数分别为8、12。面心立方最密堆积晶胞原子数为:8×
,对于体心立方晶体,离中心原子最近的原子有8个;对于面心立方晶体,任取其中一个原子为原点作x、y、z三个平面,构成空间直角坐标系,那么,在每一个平面中,都有四个配位原子在其左上、左下、右上、右下。三个平面共12个,所以铁的体心立方堆积和面心立方最密堆积的配位数分别为8、12。面心立方最密堆积晶胞原子数为:8×![]() +6×
+6×![]() =4,所以晶胞质量为:
=4,所以晶胞质量为:![]() g,1pm=10-12m=10-10cm由晶胞切面图
g,1pm=10-12m=10-10cm由晶胞切面图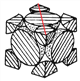 可得:面对角线长为4r pm,所以晶胞棱长为
可得:面对角线长为4r pm,所以晶胞棱长为![]() r pm,1pm=10-12m=10-10cm,则体积为:
r pm,1pm=10-12m=10-10cm,则体积为:![]() cm3,所以密度为
cm3,所以密度为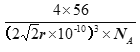 g/cm3。
g/cm3。

【题目】氰化钠(NaCN)是一种重要的化工原料,用于电镀、冶金和有机合成医药,农药及金属处理等方面。
已知:氰化钠为白色结晶颗粒或粉末,易潮解,有微弱的苦杏仁气味,剧毒。熔点563.7℃,沸点1496℃。易溶于水,易水解生成氰化氢,水溶液呈强碱性。
(1)氰化钠中氮元素的化合价是______,用离子方程式表示NaCN溶液呈强碱性的原因:________。
(2)已知:
物质 | HCN | H2CO3 |
电离平衡常数(25℃) | Ka=6.2×10-10 | Ka1=4.5×10-7,Ka2=4.7×10-11, |
则向NaCN溶液通入少量CO2反应的离子方程式:_______________。
(3)用下图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法错误的是________________。
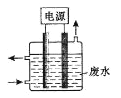
A.用石墨作阳极,铁作阴极
B.阳极的电极反应式为:Cl-+2OH--2e-=ClO-+H2O
C.阴极的电极反应式为:2H2O+2e- =H2↑+2OH-
D.除去CN-的反应:2CN-+5ClO-+2H+ =N2↑+2CO2↑+5Cl-+H2O
(4)氰化钠可用双氧水进行消毒处理。
用双氧水处理氰化钠产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,请写出该反应的化学方程式____________;
(5)过碳酸钠(2Na2CO3·3H2O2)具有Na2CO3和H2O2的双重性质,也可用于含氰废水的消毒处理。
① 下列物质中,不会引起过碳酸钠发生氧化还原反应的有___________。
A. FeC13 B. CuSO4 C. Na2SiO3 D. KCN
② 已知 6KMnO4 + 5(2Na2CO3·3H2O2)+19H2SO4=3K2SO4+6MnSO4+10Na2SO4+10CO2↑+15O2↑+34H2O.现称取0.2000g 过碳酸钠样品于250mL 锥形瓶中,加50mL蒸溜水溶解,再加50mL 2.0000molL-1H2SO4,用0.0200 molL-1 KMnO4标准溶液滴定至终点时消耗30.00mL,则产品中H2O2的质量分数为______。