题目内容
在372K时,把0.5molN2O4通入体积为5L的真空密闭容器中,立即出现红棕色。反应进行到2s时,NO2的浓度为 0.02mol·L-1。在60s时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法正确的是( )
A. 前2s以N2O4的浓度变化表示的平均反应速率为0.01mol·L-1·s-1
B. 在2s时体系内压强为开始时的1.1倍
C. 在平衡时体系内含有N2O40.25mol
D. 平衡时,N2O4的转化率为40%
B
【解析】N2O4和NO2存在如下转化关系N2O4 2NO2,前2s时
2NO2,前2s时
N2O4  2NO2
2NO2
起始(mol) 0.5 0
反应(mol) 0.05 0.02×5
2s时(mol) 0.5-0.05 0.02×5
v(N2O4)=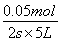 =0.005mol·L-1·s-1
=0.005mol·L-1·s-1
气体总的物质的量为0.5mol-0.05mol+0.02mol·L-1×5L=0.55mol。
2s时与开始的压强之比为p(2s)∶p(始)=0.55∶0.5=1.1∶1。
60s达到平衡时,设参加反应的N2O4的物质的量为x。则有
N2O4 2NO2
2NO2
起始(mol) 0.5 0
反应(mol) x 2x
平衡(mol) 0.5-x 2x
平衡时,气体总的物质的量为0.5mol-x+2x=0.5mol+x,所以有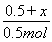 =1.6,解得x=0.3mol。
=1.6,解得x=0.3mol。
平衡体系中含0.2molN2O4,N2O4的转化率为 ×100%=60%。
×100%=60%。

练习册系列答案
相关题目