��Ŀ����
����Ŀ����80��ʱ����0.4mol�������������������2L�ѳ�յĹ̶��ݻ����ܱ������У���һ��ʱ��Ը������ڵ����ʽ��з������õ��������ݣ�
c(mol��L-1) | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4) | 0.20 | a | 0.10 | C | d | e |
c(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
��Ӧ������100s��Ӧ�������¶Ƚ��ͣ������������ɫ��dz��
��1���÷�Ӧ�Ļ�ѧ����ʽΪ________________________________��
��2��20sʱ��N2O4�ĵ�Ũ��Ϊ__________mol��L-1��0��20s��N2O4��ƽ����Ӧ����Ϊ_____________��
��3���÷�Ӧ��ƽ�ⳣ������ʽK=____________��80�淴ӦKֵΪ___________����2λС��)��
��4��������������ͬʱ���÷�Ӧ��KֵԽ��������ƽ��ʱ______________��
A��N2O4��ת����Խ�� B��NO2�IJ���Խ��
C��N2O4��NO2��Ũ��֮��Խ�� D������Ӧ���еij̶�Խ��
��5��Ҫ����÷�Ӧ��Kֵ���ɲ�ȡ�Ĵ�ʩ_________
A������N2O4��ʼŨ�� B����������ͨ��NO2
C��ʹ�ø�Ч���� D�������¶�
��6����ͼ��80��ʱ������N2O4Ũ�ȵı仯ͼ�����ڸ�ͼ�в������÷�Ӧ��60�淴ӦʱN2O4Ũ�ȵı仯����_______��
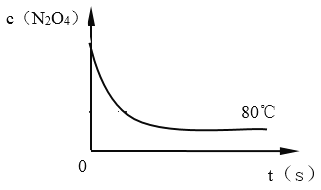
���𰸡� N2O4![]() 2NO2 0.14 0.003 mol/(L��s)
2NO2 0.14 0.003 mol/(L��s) 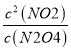 0.54 ABD D
0.54 ABD D 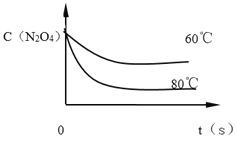
����������1���÷�Ӧ�Ļ�ѧ����ʽΪ��N2O4![]() 2NO2����2�����е�20S��
2NO2����2�����е�20S��
N2O4![]() 2NO2
2NO2
��ʼ����mol�� 0.4 0
�仯����mol�� 0.12 0.24
20sĩ��mol�� 0.28 0.24
20sʱ��N2O4��Ũ��=![]() =0.14mol/L��
=0.14mol/L��
0��20s��N2O4��ƽ����Ӧ����=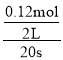 =0.003mol/(Ls)��
=0.003mol/(Ls)��
��3��N2O4![]() 2NO2��ƽ�ⳣ��K=
2NO2��ƽ�ⳣ��K=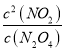 ��
��
80��Cƽ��״̬��60S����ͬƽ��״̬��ƽ��Ũ��c��NO2��=0.22mol/L��c��N2O4��=0.09mol/L��
ƽ�ⳣ��K=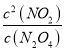 =
=![]() =0.54mol/L��
=0.54mol/L��
��4����Ӧ������100s��Ӧ�������¶Ƚ��ͣ������������ɫ��dz��˵����Ӧ���淴Ӧ�����ƶ����淴Ӧ�Ƿ��ȷ�Ӧ������Ӧ�����ȷ�Ӧ���÷�Ӧ��KֵԽ��˵��ƽ��������У����¶Ƚ��͵�ԭ��A��ƽ���������N2O4��ת����Խ�ߣ�ѡ��A��ȷ��B��ƽ���������NO2�IJ���Խ��ѡ��B��ȷ��C�����������������ƽ��������У�N2O4��NO2��Ũ��֮��ԽС��ѡ��C����D���÷�Ӧ��KֵԽ��˵��ƽ��������У�����Ӧ���еij̶�Խ��ѡ��D��ȷ����ѡABD����5��ƽ�ⳣ��ֻ���¶�Ӱ�죬Ҫ����÷�Ӧ��Kֵ��Ӧ�ı��¶�ʹƽ��������Ӧ�����ƶ����÷�Ӧ����Ӧ�����ȷ�Ӧ����Ӧ�����¶�ƽ��������Ӧ�����ƶ���ƽ�ⳣ��K����ѡD����6���¶Ƚ��ͣ���ѧ��Ӧ���ʼ���������ƽ���ʱ�䳤��ͬʱ���¶Ƚ��ͣ���ѧƽ������ȵķ����ƶ������淴Ӧ�����ƶ�������ͼ��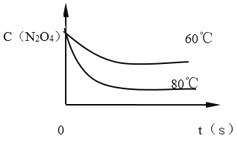 ��
��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��Ŀǰ��ҵ�Ͽ�����CO��CO2������ȼ�ϼ״���ij�о�С��������йؼ״���ȡ��������ѧ��Ӧԭ������̽������֪�ڲ�ͬ�¶��µĻ�ѧ��Ӧƽ�ⳣ��(K1��K2��K3)���±���ʾ��
��ѧ��Ӧ | �ʱ� | ƽ�ⳣ�� | �¶�/�� | ||
500 | 700 | 800 | |||
��2H2(g)��CO(g) | ��H1 | K1 | 2.5 | 0.34 | 0.15 |
��CO2(g)��H2(g) | ��H2 | K2 | 1.0 | 1.70 | 2.52 |
��CO2(g)��3H2(g) | ��H3 | K3 | |||
��ش��������⣺
(1)��Ӧ����________(��������������������)��Ӧ��
(2)���ݷ�Ӧ����ڿ��Ƶ���K1��K2��K3֮��Ĺ�ϵ����K3��________(��K1��K2��ʾ)�����ݷ�Ӧ���ж���S___0(����>��������������<��)����______(�����ϸ��������ϵ���)�¶��������ڸ÷�Ӧ�Է����С�
(3)500��ʱ����÷�Ӧ����ijʱ�̣�CO2(g)��H2(g)��CH3OH(g)��H2O(g)��Ũ�ȷֱ�Ϊ0.1mol/L��0.8mol/L��0.3mol/L��0.15mol/L