题目内容
将0.1 mol的镁和铝的混合物溶于50 mL 4 mol·L-1 H2SO4溶液中,然后再滴加2 mol·L-1的NaOH溶液。请回答下列问题:
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V的变化如图所示。当V1=80 mL时,计算金属粉末中镁的物质的量及V2的体积。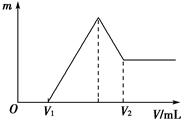
(2)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,计算滴入NaOH溶液的体积。
(1) n(Mg)="0.06mol" (2分); V2=220mL(2分)
(2)V(NaOH)=200mL(2分)
解析试题分析:(1)由图像可知:V1 mL的NaOH溶液是与过量H2SO4反应的,则与Mg、Al反应的为H2SO4:
0.2mol-0.16mol× =0.12mol。假设n(Mg)=x mol,n(Al)=y mol,根据反应关系式 ,解得:x=0.06 mol,y=0.04 mol。当加入V2 mL NaOH溶液时,得到Mg(OH)2↓和NaAlO2,关系式为:
Mg2+~2OH-,Al3+~4OH-,∴V2=80+140 =220 mL。(2)当Mg2+、Al3+刚好沉淀完全时,溶液中只有Na2SO4,关系式为2NaOH~H2SO4,∴V(NaOH)= =200 mL。
考点:考查镁和铝与酸反应的计算、化学图像的相关计算。

标准状况下,1体积水中能溶解500体积的HCl气体。若向1 L水中通入标准状况下的448LHCl气体,假设气体完全溶解。
(1)若所得溶液密度为1.2 g/cm3,则溶液中含HCl物质的量浓度为 ;
(2)从该溶液中取出10mL浓盐酸溶解于水配制成500mL溶液,配制后的稀溶液中含HCl物质的量浓度为 。
(3)在用浓盐酸配制上述稀盐酸时,所用仪器中,使用前必须检查是否漏液的仪器有 ;配制过程中,造成浓度偏低的操作可能有_______________(选填下列操作的序号)。
| A.容量瓶蒸馏水洗后未加干燥 |
| B.量筒用蒸馏水洗后未干燥 |
| C.将烧杯中浓盐酸移入容量瓶后,未用水洗涤烧杯,即向容量中加水到刻度 |
| D.用胶头滴管向容量瓶中加水时,不慎超过刻度线,用另外胶头滴管从瓶中吸出部分溶液使剩余溶液刚巧达刻度线 |
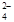 + 2Fe2+ + 4H+
+ 2Fe2+ + 4H+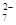 + 6 Fe2+ + 14 H+ →2 Cr3+ + 6 Fe3+ + 7 H2O
+ 6 Fe2+ + 14 H+ →2 Cr3+ + 6 Fe3+ + 7 H2O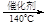 4N2 + 6H2O 6NO2 + 8NH3
4N2 + 6H2O 6NO2 + 8NH3