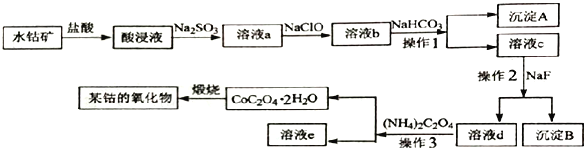
题目内容
【题目】碱式碳酸镁和无水氯化镁具有广泛的用途。用白云石(CaCO3·MgCO3)为主要原料生产碱式碳酸镁和无水氯化镁的流程如下:
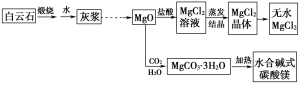
回答下列问题:
(1)“灰浆”中除水和MgO外,主要成分还有________________________。
(2)为探究所得的水合碱式碳酸镁[mMgCO3·nMg(OH)2·xH2O]的组成,某同学组装仪器如图所示:
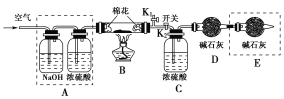
实验测得:硬质玻璃管中剩余的固体质量为1.60 g,C处浓H2SO4增重0.72 g,D处碱石灰(主要成分为氧化钙和氢氧化钠)增重1.32 g,此水合碱式碳酸镁的化学式为________。
(3)A框中装置的作用是___________________________________________;在装好试剂后,加热前应进行的操作是_______________________________。
【答案】Ca(OH)23MgCO3·Mg(OH)2·3H2O除去空气中的CO2等酸性气体和水蒸气,以减少误差打开K1,关闭K2,通入足量空气后,再打开K2,关闭K1
【解析】
(1)碳酸钙、碳酸镁分解得到氧化钙、氧化镁,氧化镁不溶于水,氧化钙可以和水反应得到Ca(OH)2,因此“灰浆”中除水和MgO外,主要成分还有Ca(OH)2。
(2)水合碱式碳酸镁的化学式为mMgCO3·nMg(OH)2·xH2O,受热分解生成氧化镁、二氧化碳和水。硬质玻璃管中剩余的固体质量为1.60g,即氧化镁是1.60g,物质的量是1.60g÷40g/mol=0.04mol。C处浓H2SO4增重0.72g,即生成的水是0.72g,物质的量是0.72g÷18g/mol=0.04mol。D处碱石灰(主要成分为氧化钙和氢氧化钠)增重1.32g,说明生成的二氧化碳质量是1.32g,物质的量是1.32g÷44g/mol=0.03mol。所以根据原子守恒可知m:n:x=0.03:(0.04-0.03):(0.04-0.01)=3:1:3,因此化学式为3MgCO3·Mg(OH)2·3H2O;
(3)实验需要通过测量D装置内碱石灰的增重,计算生成的二氧化碳的质量,通过测量C装置装置,计算生成的水的质量,而空气中含有水蒸气以及二氧化碳等,所以A框中装置的作用是除去空气中的CO2等酸性气体和水蒸气,以减少误差;由于要排除空气中的水以及二氧化碳的干扰,开始之前要先通空气,排尽装置中的空气,再进行试验,所以在装好试剂后,加热前应进行的操作是打开K1,关闭K2,通入足量空气后,再打开K2,关闭K1。