��Ŀ����
����Ŀ����2L�ܱ������ڣ�800��ʱ��Ӧ��2NO(g)+O2(g)![]() 2NO2(g)����ϵ��n(NO2)��ʱ��ı仯�����
2NO2(g)����ϵ��n(NO2)��ʱ��ı仯�����
ʱ��(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)(mol) | 0.00 | 0.010 | 0.012 | 0.013 | 0.013 | 0.013 |
��1��д���÷�Ӧ��ƽ�ⳣ������ʽ��K=____________����֪��K��350����300��������÷�Ӧ��________��������ţ��ȷ�Ӧ��
��2����ͼ�б�ʾNO�ı仯��������_________������ĸ����O2��ʾ��0~2 s�ڸ÷�Ӧ��ƽ������v=_________��
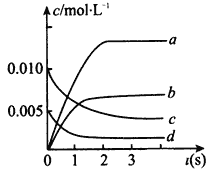
��3����˵���÷�Ӧ�Ѵﵽƽ��״̬����______________������ĸ��
A��c(NO2)=2c(O2) B��������ѹǿ���ֲ���
C��v�� (NO)=2v��(O2) D���������ܶȱ��ֲ���
���𰸡� K=![]() �� c 1.5��10-3mol��L��1��s��1 BC
�� c 1.5��10-3mol��L��1��s��1 BC
��������(1)��Ӧ2NO(g)+O2(g)2NO2(g)��ϵ�У�ƽ�ⳣ��Ϊ����Ũ��ϵ�����ݵij˻��뷴Ӧ��Ũ��ϵ�����ݵij˻��ı�ֵ��K=![]() ��K(300��)��K(350��)�������¶ȣ�K��С���������¶�ƽ�����淴Ӧ�����ƶ��������淴Ӧ�������ȣ�����Ӧ����Ϊ���ȷ�Ӧ���ʴ�Ϊ��
��K(300��)��K(350��)�������¶ȣ�K��С���������¶�ƽ�����淴Ӧ�����ƶ��������淴Ӧ�������ȣ�����Ӧ����Ϊ���ȷ�Ӧ���ʴ�Ϊ�� ![]() ���ţ�
���ţ�
(2)NO��O2�Ƿ�Ӧ�Ũ����С���ұ仯��NOΪ����Ũ�ȱ仯����2������˱�ʾNO�仯��������c��2s����NO2��ʾ��ƽ����Ӧ����v(NO2)=![]() =
=![]() =3.0��10-3molL-1s-1������֮�ȵ��ڻ�ѧ������֮�ȣ�����v(O2)=
=3.0��10-3molL-1s-1������֮�ȵ��ڻ�ѧ������֮�ȣ�����v(O2)=![]() v(NO2)=
v(NO2)=![]() ��3.0��10-3molL-1s-1=1.5��10-3molL-1s-1���ʴ�Ϊ��c��1.5��10-3molL-1s-1��
��3.0��10-3molL-1s-1=1.5��10-3molL-1s-1���ʴ�Ϊ��c��1.5��10-3molL-1s-1��
(3)A��ƽ��ʱc(NO2)��c(O2)����������й���ƽ��ʱ��һ������c(NO2)=2c(O2)������˵���ﵽƽ�⣬��A����B���淴Ӧ���У���Ӧ��������ܵ����ʵ����ڼ�С�����������ʵ������ֲ��䣬����ѹǿ���䣬˵����Ӧ����ƽ�⣬��B��ȷ��C����ͬ���ʱ�ʾ���ʣ�����ƽ��ʱ����������֮�ȵ��ڻ�ѧ������֮�ȣ�v�� (NO)��v��(O2)=2��1����v�� (NO)=2v��(O2)����C��ȷ��D�������������������䣬�����ݻ�Ϊ��ֵ�������ܶ���ʼ���ղ��䣬����˵���ﵽƽ�⣬��D���ʴ�Ϊ��BC��