题目内容
9.(1)0.5molCO2的质量是22g;在标准状况下所占的体积约为11.2L;所含的分子数目约为0.5NA;所含氧原子的数目约为NA.(2)已知离子反应:RO3n-+6I-+6H+═R-+3I2+3H2O,试根据离子方程式必须“质量守恒,电荷守恒,得失电子守恒”等判断:n=1,R元素在RO3n-中的化合价是+5.
分析 (1)根据m=nM、V=nVm、N=nNA结合分子构成进行有关计算;
(2)先根据电荷守恒判断n,根据元素化合价的代数和判断R化合价.
解答 解:(1)m(CO2)=nM=0.5mol×44g/mol=22g、V(CO2)=nVm=0.5mol×22.4L/mol=11.2L、N=nNA=0.5mol×NA/mol=0.5NA,N(O)=2(CO2)=NA,
故答案为:22g;11.2L;0.5NA;NA;
(2)先根据电荷守恒得n=1-6+6=1,根据元素化合价的代数和得(-1)-(-2)×3=+5,
故答案为:1;+5.
点评 本题考查物质的量有关计算、化合价判断等知识点,为高频考点,明确物质的量公式中各个物理量之间关系是解本题关键,题目难度不大.

练习册系列答案
相关题目
20.维生素C不具有的性质是( )
| A. | 难溶于水 | B. | 易溶于水 | C. | 强还原性 | D. | 酸性 |
17.下列说法正确的是( )
| A. | HNO3的摩尔质量是63g | |
| B. | 硫酸和磷酸的摩尔质量相等,都是98g/mol | |
| C. | 摩尔质量等于物质的相对原子(分子)质量 | |
| D. | 摩尔质量就是物质相对原子(分子)质量的6.02×1023倍 |
4.如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近呈蓝色.下列说法正确的是( )
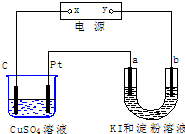

| A. | C是阳极,Pt是阴极 | |
| B. | x是负极,y是正极 | |
| C. | a极和Pt产生气体的物质的量相同 | |
| D. | CuSO4溶液pH值不变,U形管溶液pH值增大 |
14.常温下,当水电离出的c(H+)=1×10-12mol•L-1的时候,下列离子一定不能存在的是( )
| A. | Cu2+ | B. | CO32- | C. | Na+ | D. | HSO3- |
18.向NaBr、NaI、Na2SO3混合液中,通入一定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是( )
| A. | NaCl NaBr | B. | NaCl Na2SO4 | ||
| C. | NaCl Na2SO4 I2 | D. | NaCl NaI Na2SO4 |
19.既属于氧化还原反应又属于分解反应的是( )
| A. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | B. | Zn+H2SO4═ZnSO4+H2↑ | ||
| C. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O | D. | 2H2O═H2↑+O2↑ |