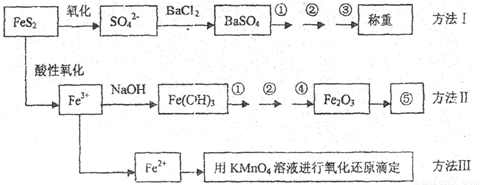
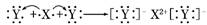题目内容
已知某物质的主要成分的化学式为XY2,X原子的结构示意图为,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.
(1)m=________,该物质的化学式为________.
(2)Z、W元素的名称为__________、__________.
(3)下列说法正确的是________.
A.XY2和WZ2都为离子化合物
B.XY2分子中仅含离子键,WZ2中仅含极性共价键
C.H2Z比HY的稳定性强
D.X的阳离子比Y的阴离子半径大
(4)下列化学用语表达正确的是________.
A.XY2的电子式:X2+[]2-
B.WZ2的结构式:Z===W===Z
C.Y元素的单质与H2Z水溶液反应的离子方程式为:Y2+Z2-===2Y-+Z↓
D.用电子式表示XY2的形成过程为:
(5)冰雪的化学成分是H2O,水的沸点比H2Z的沸点高,其原因是_____________________________________________________________________.
(1)20 CaCl2 (2)硫 碳 (3)B (4)B、D(5)水分子间存在氢键
解析:根据核外电子的排布规律可知X应是Ca元素,X的阳离子与Y的阴离子的电子层结构相同,所以Y是氯元素。原子的最外层电子数是其电子层数的2倍的,只有C元素和S元素,Z与Y相邻且Z、W能形成一种WZ2型分子,所以Z是S,W是C。
(1)(2)略
(3)CaCl2是离子化合物,只有离子键。CS2是共价化合物,含有极性键,A不正确,B正确。氯但非金属性强于S的,所以氯化氢的稳定性强于硫化氢的,C不正确。钙离子和氯离子具有相同的电子层结构,其微粒半径氯离子的对应钙离子的,D不正确。
(4)CaCl2是离子化合物,只有离子键,电子式为。CS2是直线型结构,B正确。氢硫酸是弱酸,不能改写成离子形成,正确的离子方程式为Cl2+H2S=2H++2Cl-+S↓。钙属于活泼金属,失去电子被氯得到,所以D正确。
(5)由于水中存在氢键,所以其沸点高于硫化氢的。

 ,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.
,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.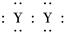 ]2-
]2- 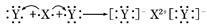
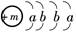 ,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.
,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.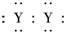 ]2-
]2-